
- •Глава 14
- •14.1. Классификация и номенклатура
- •14.1.1. Классификация эфиров
- •14.1.2. Номенклатура июпак.
- •14.2. Физические свойства простых эфиров
- •14.2.1. Спектроскопия простых эфиров
- •14.3. Получение простых эфиров
- •14.4. Химические свойства простых эфиров
- •14.5. -Оксиды
- •14.5.1. Получение -оксидов
- •14.5.2. Химические свойства эпоксидов
- •14.6. Краун-эфиры
14.2.1. Спектроскопия простых эфиров
УФ-спектроскопия. Эфирная связь не дает характерных полос колебания в видимой УФ-области спектра (λmax 180-190 нм).
ИК-спектроскопия. В ИК-спектрах наблюдается очень сильное поглощение валентных асимметрических колебаний νС‑О 1150-1050 см-1.
Масс-спектрометрия. В масс-спектрах простых эфиров интенсивность молекулярного иона в большинстве случаев мала. Фрагментация под действием электронного удара начинается с удаления электрона из неподеленной электронной пары кислорода. Затем идет фрагментация с образованием радикалов –ОСН3 (m/z 31), –ОС2Н5 (m/z 45), –ОС3Н7 (m/z 59) и т.д. Дальнейшее расщепление приводит к разрыву α-С–С связи, и радикалы отщепляются преимущественно от наиболее замещенных атомов углерода.
Спектроскопия ПМР. Сигналы протонов в ряду –ОСН3, –ОСН2СН3 и –ОСН(СН3)2 в ПМР-спектрах смещается в сторону более слабого поля и проявляется в диапазоне 3,4-3,6 м.д. Значения химических сдвигов протонов в типичных циклических эфирах приведены ниже.
|
|
|
|
|
2,54 м.д. |
3,63 (а), 1,79 (b) м.д. |
3,59 м.д. |
14.3. Получение простых эфиров
Некоторые симметричные простые эфиры, используемые в качестве растворителей, с небольшими алкильными группами, получают в промышленности. Наиболее важными из них являются диэтиловый эфир (со времен алхимиков он известен как серный эфир), применяемый как средство для наркоза, в качестве растворителя для экстракции и для получения реактивов Гриньяра, а также диизопропиловый и ди-н-бутиловый эфиры.
Межмолекулярная дегидратация спиртов. Образование эфиров, а не алкенов при дегидратации спиртов достигается выбором соответствующих условий реакций. Например, этилен получают нагреванием этилового спирта с концентрированной серной кислотой при 180 С; диэтиловый эфир образуется при нагревании этой смеси при 140 С, причем в реакционную смесь все время добавляют спирт, чтобы он был в избытке.
Образование простого эфира при дегидратации служит примером реакции нуклеофильного замещения, в которой протонированный спирт выступает в качестве субстрата, а вторая молекула спирта – в роли нуклеофила.
Теоретически реакция может протекать как по механизму SN1, так и по SN2 в зависимости от того, теряет ли протонированный спирт молекулу воды раньше или одновременно с атакой второй молекулы спирта. Вторичные и третичные спирты реагируют по SN1-механизму (1). Однако следует помнить, что в этих условиях, особенно третичные спирты, превращаются в алкены. Первичные спирты реагируют по механизму SN2 (2).
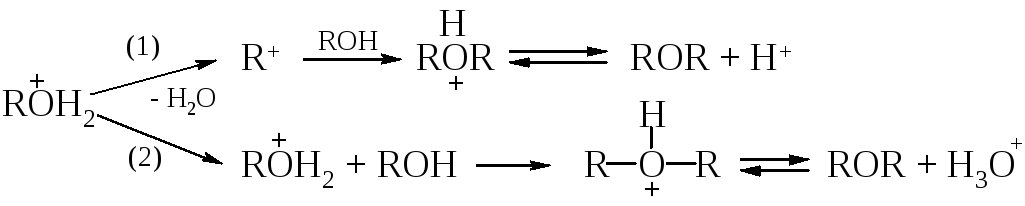
Так, из н-бутилового спирта получается ди-н-бутиловый эфир, т. е. реакция протекает без перегруппировки и, следовательно, преимущественно без образования промежуточных карбокатионов. В отличие от других вторичных и третичных спиртов изопропиловый спирт в условиях кислотного катализа дает неплохой выход диизопропилового эфира.

Применение реакции межмолекулярной дегидратации спиртов обычно ограничивается получением симметричных эфиров, поскольку при использовании двух различных спиртов образуется смесь трех эфиров: R-O-R, R-O-R' и R'-O-R'.
Кроме того, дегидратация в основном применяется для первичных низших спиртов, т.к. высшие спирты в этих условиях превращаются в алкены. Вторичные и третичные спирты вместо ожидаемых простых эфиров также в основном дают алкены.
Однако, варьируя условия синтеза и соотношение реагентов все же можно целенаправленно получать смешанные эфиры. Известно, что первичные спирты в зависимости от молекулярной массы способны в интервале от комнатной температуры до 100 С образовывать с избытком серной кислоты моноалкилсульфаты.
С2Н5ОН + HOSO2OH → C2H5OSO2OH + H2O
Если далее температуру реакции поднять до 140 ºС и вносить избыток другого простейшего первичного спирта, то удается осуществить синтез смешанного эфира:
![]()
Кроме того, из аллилового спирта в смеси с каким-либо другим спиртом в присутствии тетрахлорплатиновой(II) кислоты селективно образуются алкилаллиловые эфиры.
![]()
Если пропускать этанол над оксидом алюминия (дегидратирующим катализатором), нагретым до 375 ºС, то образуется вода и этилен, но при 250 ºС дегидратация приводит к простому эфиру.
![]()
Синтез Вильямсона. Несмотря на то, что эта реакция была открыта еще в 1852 г., она до сих пор остается наиболее общим методом получения простых эфиров. В лаборатории синтез Вильямсона в настоящее время является наиболее важным из-за его многосторонности: его можно использовать для синтеза каксмешанных, так и симметричных эфиров. В синтезе Вильямсона алкилгалогенид реагирует с алкоголятом натрия по схеме:
![]()
Реакция представляет собой нуклеофильное замещение иона галогена на алкоксид-ион; он аналогичен синтезу спиртов из галогеналканов при действии водного раствора щелочи. Например:

Если необходимо получить смешанные эфиры, то возможны две комбинации, причем одна из них почти всегда лучше. При синтезе, например, этил-трет-бутилового эфира возможны следующие комбинации:

Какой же метод выбрать? Как всегда, следует учитывать возможность реакции элиминирования. Оно должно быть особенно существенным вследствие сильной основности алкоголят-иона. Поэтому третичный галогенид, который дает только или главным образом продукт элиминирования, не применяют; следует использовать другую комбинацию. Как известно, натрий медленно реагирует с трет-бутиловым спиртом. Однако это неудобство сполна компенсируется стремлением первичных галогеналканов вступать в реакцию замещения, а не элиминирования. При планировании синтеза эфира по Вильямсону следует помнить, что тенденция галогеналканов вступать в реакцию дегидрогалогенирования уменьшается в следующем порядке: третичный > вторичный > первичный.


В случае (1) имеет место замещение, а в случае (2) – элиминирование. Последнего процесса можно избежать, если третичные галогеналканы этерифицировать в слабоосновных условиях, например, в пиридине или при использовании перхлората ртути.
При применении алкилтозилатов получение простых симметричных и смешанных эфиров протекает весьма гладко и без осложнений:
![]()
Синтез на основе алкенов. Спирты способны каталитически присоединяться к олефинам. В качестве катализатора выступают фторид бора(III) или неорганические кислоты. Таким способом синтезируют в промышленности диизопропиловый эфир, присоединяя пропанол-2 к пропену:
![]()
Метод пригоден для получения в промышленности и несимметричных простых эфиров:

Алкоксимеркурирование алкенов. Этот способ позволяет получать смешанные эфиры с высокими выходами:

Реакция, по-видимому, начинается с атаки катионом +HgOCOCH3 двойной связи алкена, что ведет к образованию интермедиата – меркуриониевого катиона, который затем раскрывается в результате нуклеофильной атаки спирта по наиболее замещенному атому углерода.

Для синтеза эфиров, содержащих вторичный или третичный алкил, следует использовать трифторацетат ртути(I):
![]()
Этот наиболее распространенный способ получения простых эфиров напоминает гидратацию алкенов по правилу Марковникова посредством оксимеркурирования-демеркурирования, а различие сводится к тому, что реакция протекает в спирте, а не воде.
Метилирование спиртов. Алкилметиловые эфиры получают взаимодействием спиртов с диазометаном в присутствии кислот Льюиса – BF3 или AlCl3, например:


