
- •Глава 13
- •13.1. Классификация, номенклатура и Строение спиртов
- •13.1.1. Классификация спиртов
- •13.1.2. Номенклатура спиртов
- •13.1.3. Строение спиртов
- •13.1.4. Изомерия
- •13.2. Физические свойства спиртов
- •13.2.1. Спектроскопия спиртов
- •13.3. Получение одноатомных спиртов в промышленности
- •13.4. Методы синтеза одноатомных спиртов в лаборатории
- •13.5. Химические свойства одноатомных спиртов
- •13.5.1. Разрыв связи с–он
- •13.5.2. Разрыв связи о–н
- •13.6. Отдельные представители одноатомных спиртов
- •13.7. Непредельные спирты и их эфиры
- •13.7.1. Енолы
- •13.7.2. Получение производных енолов
- •13.7.3. Аллиловый спирт
- •13.7.4. Высшие непредельные спирты
- •13.7.5. Ацетиленовые спирты и простые эфиры
- •13.8. Гликоли
- •13.8.1. Физические свойства гликолей
- •13.8.2. Методы синтеза гликолей
- •13.8.3. Химические свойства гликолей
- •А) реакции окисления с сохранением углеродной цепи;
- •13.8.4. Применение гликолей
- •13.9. Многоатомные спирты
- •13.9.1. Получение глицерина
- •13.9.2. Химические свойства глицерина
- •13.9.3. Применение глицерина
- •13.9.4. Многоатомные спирты
- •13.9.5. Жиры и масла
13.4. Методы синтеза одноатомных спиртов в лаборатории
Гидролиз алкилгалогенидов. Обычно спирты получают гидролизом хлоралканов при нагревании с водой или водным раствором щелочей. В первом случае реакция обратима, а во втором она часто сопровождается элиминированием галогеноводородов, например:

Во избежание побочных процессов первоначально из хлоралканов предпочтительно синтезировать сложные эфиры, которые затем омыляют до спиртов.

Для лучшей гомогенизации реакционной смеси в нее добавляют некоторое количество смешивающегося с водой растворителя, например, диоксана.
Гидроборирование-окисление алкенов. Алкены реагируют с дибораном (ВН3)2, образуя первоначально алкилбораны, которые при окислении превращаются в спирты.
![]()
Реакцию проводят в тетрагидрофуране. Диборан получают реакцией между двумя коммерческими реагентами: боргидридом натрия и фторидом бора, часто in situ (в реакционной смечи в присутствии алкена) или восстанавливают хлорид бора(III) водородом.
![]()
Алкилбораны не выделяют, а обрабатывают их в том же реакционном сосуде щелочным раствором пероксида водорода. Как видно из приведенных реакций, они протекают против классического правила Марковникова и без перегруппировок.
![]()


Следует отметить, что в реакции участвует не диборан, а его мономер, образующийся в растворе:
![]() .
.
Наряду с дибораном в органическом синтезе применяют комплекс борана в тетрагидрофуране.
![]()
Механизм реакции гидроборирования можно представить как типичное электрофильное присоединение гидрида бора по двойной связи, в котором электрофилом является атом бора. С современной точки зрения эту реакцию рассматривают как процесс, протекающий через четырехцентровый промежуточный комплекс.

По-видимому, реакция гидроборирования алкенов начинается с электрофильной атаки атома бора. В образовавшемся -комплексе на атоме бора увеличивается отрицательный заряд с тенденцией образования вторичного карбкатиона. Однако последний не образуется, потому что приобретающий отрицательный заряд атом бора легко теряет атом водорода в виде гидрид-иона с синхронным образованием продукта цис-присоединения.
Реакция окисления алкилборанов протекает следующим образом. На первой стадии гидропероксид-анион атакует электронодефицитный атом бора.

Образовавшийся интермедиат перегруппировывается благодаря миграции алкильной группы со своими электронами к атому кислорода по схеме, сходной с перегруппировкой карбкатионов.

Взаимодействие с гидропероксидом в щелочной среде протекает быстро и с выделением тепла.
![]()
Образовавшийся эфир борной кислоты легко разлагается в условиях реакции с высвобождением спирта.
![]()
Чтобы предотвратить дальнейшее окисление продуктов реакции до альдегидов и кислот, процесс проводят в атмосфере азота в присутствии борной кислоты (А. Башкиров), которая образует со спиртами стойкие к окислению эфиры борной кислоты В(ОR)3. Последние затем легко гидролизуются щелочами. Таким путем в промышленности, в частности, получают цетиловый спирт С16Н33ОН.
Реакция гидроборирования проста и удобна, выходы очень высоки, и ее можно использовать для синтеза соединений, которые трудно получить из алкенов каким-либо другим способом. Для ациклических, моно- и дизамещенных алкенов гидроборирование–окисление дает уникальную возможность синтеза первичных спиртов с суммарным выходом 80-95%.
Алкилборирование оксида углерода(II). Дальнейшее развитие методов получения спиртов из алкилборанов получило в работах Г. Брауна и М. Рашке, которые предложили в качестве акцептора алкилборана оксид углерода(II). Реакция протекает при температурах 100-125 С. В промежуточном комплексе происходит последовательная миграция алкильных групп с атома бора на атом углерода.

Этим методом в зависимости от условий проведения реакции можно получить с высоким выходом первичные, вторичные и третичные спирты.
Гидроксимеркурирование-демеркурирование алкенов приводит к образованию спиртов и не сопровождается перегруппировкой. Направление реакции соответствует правилу Марковникова; она протекает в мягких условиях, а выходы близки к теоретическим.
 Механизм
этой реакции может быть представлен
следующим образом. Первоначально
происходит диссоциация ацетата ртути(II)
с образованием иона СН3СООНg+.
Ацетоксимеркурат-катион реагирует с
двойной связью С=С алкена подобно
протону. Далее карбокатион взаимодействует
с водой, образуя алкилртутную соль.
Механизм
этой реакции может быть представлен
следующим образом. Первоначально
происходит диссоциация ацетата ртути(II)
с образованием иона СН3СООНg+.
Ацетоксимеркурат-катион реагирует с
двойной связью С=С алкена подобно
протону. Далее карбокатион взаимодействует
с водой, образуя алкилртутную соль.

Демеркурирование образующихся меркурированных спиртов протекает количественно при обработке их боргидридом натрия.

Например:

Замена воды на спирт или карбоновую кислоту приводит к получению простых или сложных эфиров. В лаборатории этот метод полностью вытеснил реакцию гидратации алкенов.
Восстановление сложных эфиров и карбоновых кислот приводит к первичным спиртам.
Каталитическое гидрирование сложных эфиров обычно проводят над платиновыми катализаторами, никелем Ренея или меднохромитовым катализатором.

В лабораторных условиях в качестве восстановителя значительно чаще используется алюмогидрид лития.

Большие количества спиртов с неразветвленной углеродной цепью, содержащих четное число атомов углерода, ранее получали в чистом виде восстановлением натрием в этиловом или бутиловом спирте сложных эфиров жирных кислот или жиров по методу Буво1-Блана2.

Восстановление оксосоединений до спиртов можно проводить водородом в присутствии катализаторов, таких как никель Ренея или платина, а также алюмогидридом лития или боргидридом натрия. При этом из альдегидов получаются первичные спирты, а из кетонов – вторичные.

Следует отметить, что боргидрид натрия в отличие алюмогидрида лития не восстанавливает карбоксильную и сложноэфирную группы, что позволяет восстанавливать карбонильную группу в их присутствии.
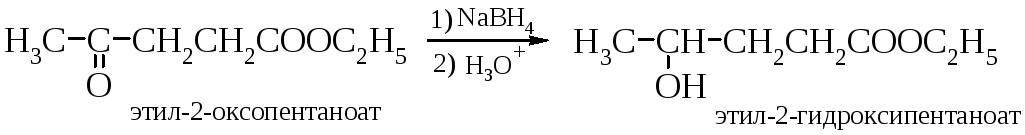
Алкил- и арилзамещенные боргидриды наряду с селективностью восстановления обеспечивают и стереоселективность.
Синтезы на основе реактива Гриньяра. Реактивы Гриньяра легко вступают во взаимодействие с карбонильными соединениями. Формальдегид при этом образует первичный спирт, остальные альдегиды – вторичные, а кетоны – третичные спирты.

При взаимодействии реактива Гриньяра со сложными эфирами получают третичные спирты, за исключением эфиров муравьиной кислоты, дающих вторичные спирты.
 Образовавшийся
кетон более активен, чем сложный эфир,
и поэтому он в первую очередь реагирует
с реактивом Гриньяра.
Образовавшийся
кетон более активен, чем сложный эфир,
и поэтому он в первую очередь реагирует
с реактивом Гриньяра.
Получение спиртов на основе оксиранов.
Органические -оксиды (оксираны или эпоксиды) также вступают в реакции с алкилмагнийгалогенидами, образуя первичные спирты.

Эпоксиды при действии алюмогидрида лития превращаются в спирты. Реакция состоит в нуклеофильной атаке гидрид-аниона по наименее замещенному (менее экранированному) атому углерода с образованием вторичного или третичного спирта.

Ввиду того, что -оксиды обычно получают из олефинов, то такой двухстадийный процесс можно рассматривать как альтернативу реакции гидратации алкенов. В отличие от последней реакции восстановление эпоксидов протекает регио- и стереоспецифично. В системах, для которых невозможно свободное вращение вокруг -связей гидроксильная группа и атом водорода имеют анти-конфигурацию, отсюда и название этого процесса – анти-гидратация.

Взаимодействие первичных аминов с азотистой кислотой приводит к образованию спиртов.
CnH2n+1NH2 + HONO → CnH2n+1OH + N2↑ + H2O
Реакция не имеет реальной синтетической значимости, т. к. сопровождается образованием большого количества побочных продуктов.
Взаимодействие галогеналканов с супероксидом калия – один из самых современных методов синтеза спиртов.
![]()
Замещение атома галогена у вторичных асимметрических атомов углерода на гидроксил сопровождается полным обращением конфигурации.
