
Органическая химия.Казань
.pdfГБОУ ВПО «КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» МИНИСТЕРСТВА
ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Кафедра общей и органической химии
Введение в ОРГАНИЧЕСКУЮ ХИМИЮ
учебное пособие для студентов заочного отделения
фармацевтического факультета
Казань 2011
ББК 24.23 УДК 547.002
Печатается по решению Центрального координационно-методического совета Казанского государственного медицинского университета
Составители:
доцент, к.х.н. Артемова Н.П.,
ст. преподаватель, к.х.н. Федюнина И.В.,
доцент, к.х.н. Халиуллин Р.Р.
под ред. профессора, д.х.н. Никитиной Л.Е.
Рецензенты:
доктор мед. наук, зав. кафедрой биохимии КГМУ, профессор Мустафин И.Г., кандидат биол. наук, доцент кафедры химии и экологии КГАСУ Бойчук В.А.
Введение в ОРГАНИЧЕСКУЮ ХИМИЮ. Учебное пособие для студентов заочного отделения фармацевтического факультета / Н.П.Артемова,
И.В.Федюнина, Халиуллин Р.Р., под ред. проф. Никитиной Л.Е. – Казань: КГМУ,
2011. – 186 с.
Пособие предназначено для студентов заочного отделения фармацевтического факультета, изучающих дисциплину «Органическая химия», а также студентов лечебного, педиатрического, стоматологического факультетов в качестве дополнительной учебной литературы к курсам «Биоорганическая химия», «Химия».
© Казанский государственный медицинский университет, 2011
СОДЕРЖАНИЕ |
|
Введение…………………………………………………………………... |
4 |
Электронная структура атома углерода |
|
в органических соединениях... ………………………………………... |
6 |
Классификация органических соединений…………………………. |
7 |
Номенклатура……………………………………………………………. |
9 |
Электронные эффекты заместителей…………………………………. |
12 |
Кислотность и основность……………………………………………… |
18 |
Углеводороды…………………………………………………………….. |
21 |
Спирты и фенолы………………………………………………………... |
27 |
Альдегиды и кетоны…………………………………………………….. |
34 |
Карбоновые кислоты……………………………………………………. |
39 |
Жиры и фосфолипиды………………………………………………….. |
46 |
Окси- и оксокислоты……………………………………………………. |
52 |
Углеводы………………………………………………………………….. |
61 |
Амины……………………………………………………………………... |
75 |
Аминокислоты…………………………………………………………… |
78 |
Гетероциклические соединения……………………………………….. |
86 |
Нуклеотиды и нуклеиновые кислоты………………………………… |
96 |
Низкомолекулярные биорегуляторы…………………………………. |
103 |
Окисление и восстановление органических соединений |
|
в процессах жизнедеятельности……………………………………….. |
117 |
Физические методы идентификации органических соединений... |
124 |
СЛОВАРЬ ОСНОВНЫХ ТЕРМИНОВ………………………………. |
157 |
Список формул для запоминания…………………………………….. |
178 |
П Р И Л О Ж Е Н И Е…………………………………………………… |
181 |
4
Введение
Органическая химия входит в блок химических дисциплин, обязательных для изучения на фармацевтических факультетах медицинских университетов и в фармацевтических академиях.
Цель курса органической химии: овладение основами органической химии как важнейшего теоретического и экспериментального базиса для изучения смежных и профильных дисциплин: биохимии, фармацевтической химии, фармакологии, фармакогнозии, токсикологической химии, фармацевтической технологии, аналитической химии, нормальной и патологической физиологии и других дисциплин и, следовательно – для формирования компетенций, необходимых современному провизору.
В соответствии с Федеральным государственным образовательным стандартом высшего профессионального образования по специальности 060301 – фармация, утвержденным 17.01.2011, важнейшими компетенциями, для формирования которых необходимо знание органической химии, являются:
1)Общекультурная компетенция ОК-1: способность и готовность анализировать социально-значимые проблемы и процессы, использовать на практике методы гуманитарных, естественнонаучных, медико-биологических и клинических наук в различных видах профессиональной и социальной деятельности.
Профессиональные компетенции (ПК)
Вобласти производственной деятельности:
2)Профессиональная компетенция ПК-4: способность и готовность к произ-
водству лекарственных средств в условиях фармацевтических предприятий и организаций, включая выбор технологического оборудования, с соблюдением международных стандартов.
3)Профессиональная компетенция ПК-5: способность и готовность к изго-
товлению лекарственных средств по рецептам врачей в условиях фармацевтических организаций, включая выбор технологического процесса, с учетом санитарных требований.
В области контрольно-разрешительной деятельности:
4)Профессиональная компетенция ПК-30: способность и готовность органи-
зовывать, обеспечивать и проводить контроль качества лекарственных средств в условиях фармацевтических предприятий и организаций.
5)Профессиональная компетенция ПК-31: способность и готовность опре-
делить перечень оборудования и реактивов для организации контроля качества лекарственных средств, в соответствии с требованиями Государственной фармакопеи и иными нормативными правовыми документами, организовывать своевременную метрологическую поверку оборудования.
6) Профессиональная компетенция ПК-32: способность и готовность к уча-
стию в организации функционирования аналитической лаборатории.
7) Профессиональная компетенция ПК-33: способность и готовность опреде-
лить способы отбора проб для входного контроля лекарственных средств в соответствии с действующими требованиями.
5 8) Профессиональная компетенция ПК-34: способность и готовность гото-
вить реактивы для анализа лекарственных средств в соответствии с требованиями Государственной фармакопеи.
9)Профессиональная компетенция ПК-35: способность и готовность прово-
дить анализ лекарственных средств с помощью химических, биологических и физико-химических методов в соответствии с требованиями Государственной фармакопеи.
10)Профессиональная компетенция ПК-36: способность и готовность интер-
претировать и оценивать результаты анализа лекарственных средств.
11)Профессиональная компетенция ПК-37: способность и готовность прово-
дить определение физико-химических характеристик отдельных лекарственных форм, в том числе таблеток, мазей, растворов для инъекций.
12)Профессиональная компетенция ПК-38: способность и готовность оцени-
вать качество лекарственного сырья (используемые органы растения, гистологическая структура, химический состав действующих и других групп биологически активных веществ).
13)Профессиональная компетенция ПК-39: способность и готовность к уча-
стию в проведении химико-токсикологического исследования с целью диагностики острых отравлений, наркотических и алкогольных опьянений.
В области научно-исследовательской и информационно-просветительской деятельности :
14)Профессиональная компетенция ПК-41: способность и готовность оказать консультативную помощь медицинским работникам и потребителям лекарственных средств и других фармацевтических товаров с учетом их физикохимических свойств.
15)Профессиональная компетенция ПК-42: способность и готовность оказать консультативную помощь работникам фармацевтических предприятий и организаций по хранению и учету наркотических средств, психотропных веществ и их прекурсоров.
16)Профессиональная компетенция ПК-43: способность и готовность к ин-
формационной работе среди врачей, провизоров по вопросам применения лекарственных средств, принадлежности их к определенной фармакотерапевтической группе, показаниях и противопоказаниях к применению, возможности замены одного препарата другим и рациональном приеме.
17)Профессиональная компетенция ПК-45: способность и готовность оказы-
вать консультативную помощь по вопросам применения и совместимости лекарственных средств и других фармацевтических товаров.
18)Профессиональная компетенция ПК-48: способность и готовность рабо-
тать с научной литературой, анализировать информацию, вести поиск.
19)Профессиональная компетенция ПК-49: способность и готовность к уча-
стию в постановке научных задач и их экспериментальной реализации.
6
Задача теоретического курса органической химии: формирование система-
тических знаний о строении, свойствах и реакционной способности органических соединений.
Задача практического курса органической химии: освоение студентами практических навыков и умений, основ органического синтеза, а также важнейших препаративных методов органической химии.
Электронная структура атома углерода в органических соединениях
Органическая химия изучает строение и химические свойства органических соединений. Органические соединения это соединения углерода с другими элементами, такими как водород, кислород, азот, сера и др.
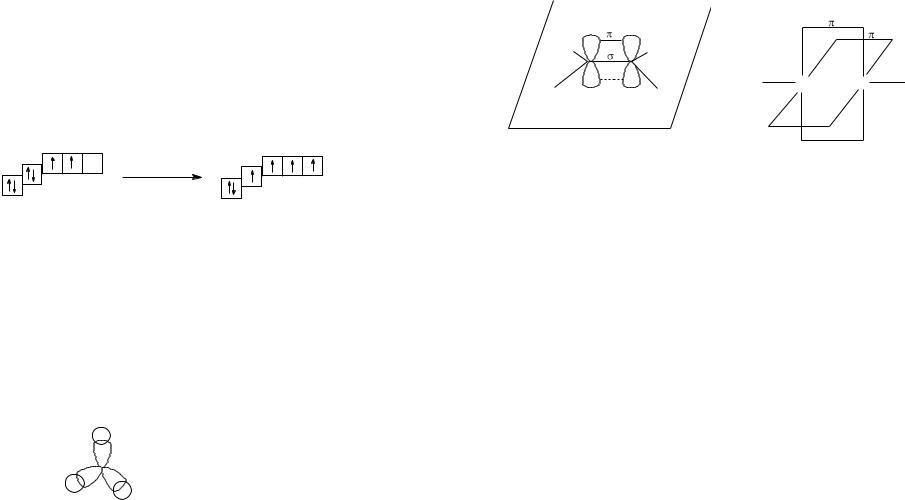
Электронная формула атома углерода – 1s22s22p2. Атом углерода легко переходит в возбужденное состояние. оно сопровождается разъединением спаренных электронов, т.е. распадом двухэлектронного облака на одноэлектронные:
2p |
|
2p |
|
2s |
2s |
||
|
|||
1s |
1s |
|
|
основное состояние |
возбужденное состояние |
||
Атом углерода в возбужденном состоянии четырехвалентен. Все четыре валентных электрона атома углерода являются эквивалентными. Согласно теории гибридизации, из s- и p-орбиталей образуются гибридные орбитали, являющиеся равноценными по форме и энергии. В зависимости от числа орбиталей, участвующих в гибридизации, возможны три ее вида.
Вsp3-гибридизации участвуют четыре орбитали (одна s- и три p-орбитали)
собразованием четырех равноценных гибридных орбиталей. sp3-гибридные орбитали имеют грушевидную форму и располагаются в пространстве друг относительно друга под углом 109,5°, как это показано на примере молекулы метана
(рис.1):
Рисунок 1
H
C
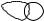 H
H
H
H
Если соединить вершины этих орбиталей, то получится тетраэдр, поэтому атом углерода в состоянии sp3-гибридизации называется тетраэдрическим.
В sp2-гибридизации участвуют одна s- и две p-орбитали, и образуются три гибридные орбитали. sp2-гибридные орбитали лежат в одной плоскости. Угол
7
между ними равен 120°. Одна р-орбиталь остается негибридизованной. Она сохраняет правильную гантелеобразную форму и располагается перпендикулярно плоскости, в которой лежат три sp2-гибридные орбитали, как это показано на примере молекулы этилена (рис.2).
Рисунок 2 |
Рисунок 3 |
|
|
|
|
H H
C C
H H H C  C H
C H
ацетилен
этилен
В sp-гибридизации участвуют одна s- и одна р-орбитали. В результате образуются две гибридные орбитали. Они располагаются друг относительно друга под углом 180º, то есть на одной прямой, и направлены в противоположные стороны от ядра атома. Поэтому молекулы, содержащие атом углерода в состоянии sp-гибридизации, имеют линейное строение. Две не участвующие в гибридизации p-орбитали располагаются во взаимно перпендикулярных плоскостях, как это показано на примере ацетилена (рис.3).
Классификация органических соединений
Органические соединения классифицируют по строению углеродной цепи и по функциональным группам, входящим в состав молекул. Функциональные группы – -NH2, -COOH, -OH и др. определяют химические свойства соединения.
По строению углеродной цепи различают ациклические и циклические соединения.
1.Ациклические соединения (не имеют цикла), в которых углеродная цепь может быть неразветвленной и разветвленной.
CH3-CH2-CH2-CH3 |
CH2=CH- |
|
C=CH2 |
CH3- |
CH-CH2-CH2-CH=O |
|
|
||||
|
OH |
CH3 |
|||

8
2.Циклические соединения (имеют цикл). Если цикл молекулы состоит только из атомов углерода и водорода, то это карбоциклические соединения, например, циклопропан, циклобутан, циклопентан, циклогексан.
циклопропан |
циклобутан |
циклопентан циклогексан |
Если же в состав цикла, кроме атомов углерода и водорода, входят гетероатомы (N, O, S), то такое соединение является гетероциклическим. Например, фуран, пиррол, тиофен.
О |
N |
S |
|
H |
|
фуран |
пиррол |
тиофен |
В зависимости от того, какие функциональные группы входят в состав молекул, органические соединения делятся на классы (табл.1). Например, в молекуле пропионовой кислоты СH3-CH2-COOH имеется карбоксильная группа (-СООН), поэтому данное соединение относится к классу карбоновых кислот.
|
Таблица 1 |
Классы органических соединений |
|
|
|
Класс соединения |
Функциональная группа |
|
|
Галогенпроизводные |
Hal (Cl, Br, F, J) |
Спирты, фенолы |
-OH |
Альдегиды |
-COH |
Кетоны |
C=O |
Простые эфиры |
-OR |
Сложные эфиры |
-COOR |
Карбоновые кислоты |
-COOH |
Тиоспирты |
-SH |
Сульфокислоты |
-SO3H |
Амины |
-NH2 |
Имины |
=NH |
Амиды |
-CONH2 |
Нитрилы |
-C N |
Нитросоединения |
-NO2 |
Гидразины |
-NH-NH2 |
9
Номенклатура
Для составления названий органических соединений используют три номенклатуры – тривиальную, радикально-функциональную и систематическую.
Тривиальные названия (исторически сложившиеся) указывают на какие-
то заметные свойства веществ (глицерин, глюкоза, от греч. glycys – сладкий), или на источник получения (яблочная кислота, лимонная кислота) или на область применения соединения (аскорбиновая кислота). Эти названия применяются до сих пор, однако они не отражают структуру соединений.
Название соединения по радикально-функциональной номенклатуре от-
ражает название класса, которое дает старшая функциональная группа, и названия радикалов, связанных с данной функциональной группой. Например, в со-
CH3-C-CH3
единении |
O |
группа >C=O , дающая название классу кетонов (табл.1), |
|
связана с двумя метильными радикалами (CH3-), поэтому данное соединение называется диметилкетон (тривиальное название – ацетон).
Радикально-функциональная номенклатура применима для ограниченного числа органических соединений, имеющих одну функциональную группу и простые радикалы.
|
|
|
|
Таблица 2 |
|
Названия предельных углеводородов |
|
||
|
|
|
|
|
Формула |
Название |
Формула |
|
Название |
СH4 |
метан |
C7H16 |
|
гептан |
C2H6 |
этан |
C8H18 |
|
октан |
C3H8 |
пропан |
C9H20 |
|
нонан |
C4H10 |
бутан |
C10H22 |
|
декан |
C5H12 |
пентан |
C11H24 |
|
ундекан |
C6H14 |
гексан |
C12H26 |
|
додекан |
Наиболее широко применяется систематическая номенклатура, с помощью которой можно назвать любое соединение, но для этого нужно знать ряд правил.
1. Из всех функциональных групп, имеющихся в молекуле, определяют старшую функциональную группу (табл.3).

10
Таблица 3
Важнейшие классы соединений, расположенные в порядке убывания старшинства групп
Класс |
Функциональная |
Префикс |
Суффикс |
|
группа |
|
|
Карбоновые |
-COOH |
- |
-овая |
кислоты |
|
|
кислота |
Альдегиды |
-COH |
oкco- |
-аль |
Кетоны |
C=O |
оксо- |
-он |
Спирты |
-OH |
гидрокси- |
-ол |
|
|
(окси-) |
|
Тиолы |
-SH |
меркапто- |
-тиол |
Амины |
-NH2 |
амино- |
-амин |
Нитросоединения |
-NO2 |
нитро- |
- |
Простые эфиры |
-OR |
алкокси- |
- |
Алкены |
C=C |
- |
-ен |
Алкины |
-C C- |
- |
-ин |
Чем выше в таблице расположена функциональная группа, тем она старше. Например, в соединении А
A CH3-CH2-CH2-CH2-CH-C
 O
O
 H
H
NH2
присутствуют два заместителя – аминогруппа –NH2 и альдегидная группа – СОН. В таблице 3 альдегидная группа расположена выше группы –NH2, следовательно, она старше. Именно старшая группа определяет принадлежность к классу органических соединений (в данном примере это альдегид, а не амин) и отражается в окончании названия (см. графу «окончание» табл.3), т.е. окончание будет –аль..
2.Определяют корень названия. Для этого выбирают главную углеродную цепь, которая должна содержать максимальное количество углеродных атомов и старшую функциональную группу.
3.Нумеруют углеродную цепь со стороны старшей функциональной груп-
пы.
6 5 4 3 2 1 O
CH3-CH2-CH2-CH2-CH-C
H
NH2
11
4. Определяют название главной углеродной цепи. В молекуле А шесть углеродных атомов, что соответствует углеводороду «гексан» (табл.2), поэтому корень названия данного соединения – гексан.
6 |
5 |
4 |
3 |
2 |
1 |
O |
|
|
|
|
|
|
|
|
|
Б CH3-CH=CH-CH2-CH-C |
H |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
||
Углеродная цепь соединения Б также содержит шесть углеродных атомов, |
|||||||
однако в молекуле имеется двойная связь, |
поэтому в корне названия гексан |
||||||
окончание -ан заменяется на –ен (гексен). Двойная связь находится после четвертого углеродного атома - гексен-4.
Название старшей функциональной группы (табл.3) обозначается в виде окончания (в приведенных примерах –СОН дает окончание –аль).
5. Все остальные заместители указывают в виде приставки и цифр, определяющих их местоположение (в приведенных примерах группа –NH2 дает приставку 2-амино-).
Соединение А – 2-аминогексаналь-1 Соединение Б – 2-аминогексен-4-аль-1
Названия наиболее распространенных радикалов приведены в таблице 4.
|
|
|
Таблица 4 |
|
Наиболее часто встречающиеся углеводородные радикалы |
||||
|
|
|
|
|
Радикал |
Название |
Радикал |
Название |
|
CH3- |
метил |
CH3-C(CH3)2CH2- |
неопентил |
|
CH2= |
метилен |
CH3CH2-С(CH3)2- |
трет.- |
|
|
|
|
пентил |
|
CH |
метин |
CH2=CH- |
винил |
|
C2H5- |
этил |
CH3-CH=CH- |
пропенил |
|
CH3-CH2-CH2- |
н-пропил |
CH2=CH-CH2- |
аллил |
|
(CH3)2CH- |
изопропил |
C6H5- |
фенил |
|
CH3CH2CH2CH2- |
н-бутил |
C6H5-CH2- |
бензил |
|
(CH3)2CHCH2- |
изобутил |
CH3-C6H4- |
толил |
|
CH3CH2CH(CH3)- |
втор.-бутил |
C6H5-CH=CH- |
тирил |
|
(CH3)3С- |
трет.-бутил |
CH3-CO- |
ацетил |
|
C5H11- |
пентил |
C6H5 CO- |
бензоил |
|
CH3CH(CH3)CH2CH2- |
изопентил |
СH3-O- |
метокси |
|

12
ЗАДАНИЯ
1.Найдите ошибки в формулах:
а) CH3-CH2-CH3-CH3
б) CH2=CН-C=CH2
OH
в) CH3-CH2-CH2-CH2-CH=OН
CH3 O
2.Назовите соединения по систематической номенклатуре:
|
|
|
O |
O |
|
|
|
|
|
O |
|
а) CH -CH |
-CH-C |
в) |
C-CH-CH2-CH-CH2-C |
||||||||
3 |
2 |
|
OH |
H |
|
|
|
|
|
H |
|
|
|
|
OH |
|
NH2 |
|
|||||
|
|
NH2 |
|
|
|
|
|||||
|
|
|
O |
г) |
|
|
|
|
|
|
O |
б) CH3-CH-CH=CH-C |
CH2-CH=CH-C |
-C |
|
||||||||
|
|
|
OH |
|
|
|
|
|
|
|
OH |
|
Cl |
|
|
OH |
|
|
O |
||||
|
|
|
|
|
|
||||||
3.Напишите формулы следующих соединений: а) пентандиол-1,2, б) 2- окси-пропановая кислота, в) бутен-2-овая кислота, г) 2-амино-3- бромпентаналь.
Электронные эффекты заместителей
Для того, чтобы сравнить реакционную способность соединений или дать характеристику их кислотно-основных свойств, необходимо знать распределение электронной плотности в молекуле.
Введение в молекулу углеводорода какой-либо функциональной группы приводит к смещению электронной плотности в молекуле, а это, в свою очередь, влияет на скорость, а иногда и на направление реакции.
Существуют два механизма передачи электронной плотности в молекуле – индуктивный и мезомерный. Знание этих эффектов необходимо, чтобы пределить донором или акцептором является данная функциональная группа в соединении.
Индуктивный эффект
Атомы, входящие в состав органических молекул, обладают разной электроотрицательностью. Электроотрицательность – это способность атомов оттягивать на себя электронную плотность.
13
При обсуждении электронных эффектов принято считать, что электроотрицательности атомов углерода и водорода равны. Все остальные атомы, такие как кислород, азот, сера и галогены, более электроотрицательны, чем углерод, и оттягивают на себя электронную плотность.
Смещение электронной плотности вдоль ζ-связи называется индуктивным эффектом и обозначается буквой I, а графически изображается стрелкой по ζ- связи.
Пример
δ”+ δ’+ δ+ |
δ- |
|
CH3→CH2→CH2→OH |
OH-группа -I, СН3-группа +I |
|
Индуктивный |
эффект |
может быть положительным и отрицательным |
(табл.5).
Положительный индуктивный эффект (+I) проявляют электронодонорные заместители (алкильные группы: СН3-, С2Н5-, С3Н7- и т.д.). Электронодонорные (ЭД) заместители отталкивают от себя электронную плотность, т.е. подают ее в молекулу.
|
|
|
|
Таблица 5 |
|
Электронные эффекты некоторых заместителей |
|||
|
|
|
|
|
|
|
Электронные эффекты |
Характер |
|
Заместитель |
|
индуктивный |
мезомерный |
совместного |
|
|
|
|
действия |
Алкильные груп- |
|
|
|
|
пы (R) |
|
+I |
- |
Электроно |
-NH2,-NHR, -NR2 |
|
-I |
+M |
доноры |
-OH |
|
-I |
+M |
|
-OR (-OAlk) |
|
-I |
+M |
|
-SH |
|
-I |
+M |
|
Галогены (F, Cl, |
|
|
|
|
|
|
|
|
|
Br, I) |
|
-I |
+M |
Электроно |
>C=O |
|
-I |
-M |
|
|
акцепторы |
|||
-COOH, -COOR |
|
-I |
-M |
|
|
|
|||
-NO2 |
|
-I |
-M |
|
-CN |
|
-I |
-M |
|
-SO3H |
|
-I |
-M |
|
|
|
|
|
|
Прежде чем рассмотреть мезомерный эффект, необходимо ввести понятие сопряжения, так как мезомерный эффект проявляется только в сопряженных молекулах.
14
Сопряжение
Двойные связи, входящие в состав соединения, могут быть сопряженными и изолированными. Если в молекуле двойные связи чередуются с одинарными, то такие соединения являются сопряженными, например, бутадиен-1,3, пентади- ен-1,3, акриловая кислота:
CH2=CH-CH=CH2 |
бутадиен-1,3 |
CH2=CH-CH=CH-CH3 |
пентадиен-1,3 |
СH2=CH-COOH |
акриловая кислота |
Примеры соединений с изолированными двойными связями: СH2=CH-CH2-COOH бутен-3-овая кислота
CH3-CH=CH-CH2-CH=CH-CH3 гептадиен-2,5 СH2=CH-CH2-CH=CH-CH2-OH гексадиен-2,5-ол-1
Рассмотрим молекулу бутадиена-1,3:
Рисунок 4
1 2 3 4
CH2-CH-CH-CH2
СН2=СН-СН=СН2.
Между первым и вторым, а также между третьим и четвертым атомами углерода имеются π-связи (как в этилене), которые образуются при перекрывании негибридизованных р-орбиталей атомов углерода (рис.4). В молекуле бутадиена- 1,3 происходит также перекрывание р-орбиталей второго и третьего углеродных атомов, что приводит к образованию общей π-электронной системы. В молекуле бутадиена-1,3 осуществляется π,π-сопряжение, т.к. в сопряжение вступают орбитали π-связей.
Примеры π,π-сопряженных систем: СН2=СН-СН=СН2 бутадиен-1,3
СH3-CH=CH-CH=CH-CH3 гексадиен-2,4
СH2=CH-C=O акриловая кислота ОН
В сопряжении могут участвовать π-связь и соседний атом с р-орбиталью, имеющей пару электронов (рис.5). Такой вид сопряжения называют р,π-
сопряжением.
Рисунок 5
СH2=CH-NH2
15
CH2-CH-NH2
Примеры р,π-сопряженных систем:
ŃH2=CH-O-CH3 CH3-CH=CH-NH2 CH2=CH-Cl
Мезомерный эффект - это передача электронного влияния заместителя по сопряженной системе. Функциональные группы, имеющие кратные связи между атомом углерода и кислородом (или азотом, или серой), могут участвовать в π,π- сопряжении молекулы. Например,
O |
O |
C |
|
СH2=CH-C |
OH |
H |
|
пропеналь |
бензойная кислота |
|
C N |
бензонитрил
В этом случае заместители оттягивают электронную плотность на себя и проявляют отрицательный мезомерный эффект (-М). В оставшейся части молекулы электронная плотность понижается. Такие заместители являются электроноакцепторными.
Функциональные группы, имеющие гетероатом с р-орбиталью (-NH2, -ОH, -SH, -OCH3), могут участвовать в р,π-сопряжении молекулы. Например,
OH |
OCH3 |
Cl |
фенол |
метоксибензол хлорбензол |
|
CH3-CH=CH-NH2 |
CH2=CH-SH |
|
пропен-1-амин-1 |
этентиол |
|
|
16 |
|
17 |
|
В этом случае заместители смещают электронную плотность от себя (пода- |
б) СН3СН=С=СНСН(NH2)CH2CH=CHCOOH |
|
ют ее в молекулу) и проявляют положительный мезомерный эффект (+М). В ос- |
в) СН3ОСН=СНСН2ССН(F)CH3 |
||
тавшейся части молекулы электронная плотность повышается. Такие заместите- |
|
║ |
|
ли являются электронодонорными. |
|
O |
|
|
Графически мезомерный эффект изображается изогнутыми стрелками. |
г) СH2=C(CH3)C≡N |
|
|
|
д) НОСН2СН(СН3)СН=СНСН2ОН |
|
|
У п р а ж н е н и я |
е) H2NCH2CH(Br)C≡CCH2SH |
|
|
|
ж)С2Н5ОСН=СНСН(СН)3СН2СН3 |
|
|
1. Напишите структурные формулы следующих соединений: |
8. Напишите структурные формулы всех возможных изомеров общей формулы |
|
|
а) 3-этил-4,4-дибромгептен-2-аль |
С3Н4О, дайте им названия по систематической номенклатуре, укажите тип |
|
|
б) 2-изопропокси-3,5-динитробензойная кислота |
гибридизации атомов углерода в этих молекулах. |
|
|
в) 5-меркаптооктади-6,7-енон-2 |
9. Напишите структурные формулы всех возможных изомеров общей формулы |
|
|
г) 2-амино-3,3-диэтилциклопентанол |
С2Н4О2. К каким классам органических соединений они относятся? |
|
|
д) 2-винилциклопропанкарбальдегид |
10.Напишите структурные формулы следующих соединений, укажите электрон- |
|
|
е) 4-хлор-5-метилдекатри-1,3,5-ен |
ные эффекты заместителей и тип гибридизации атомов углерода в этих молеку- |
|
|
|
лах: |
|
2. |
Назовите по систематической номенклатуре: |
а) 2-нитро-4-винилциклопентанол-1 |
|
|
а) СH2=CHCH(OH)CH2CH2CH2CH2OC2H5 |
б) 3-этокси-4-аминобензальдегид |
|
|
б) CH3CH(NO2)CH2C(CH3)2CH(OH)CH2COOH |
в) 2-меркапто-3-фенил-5-изопропилгептин-6 |
|
|
в) HC≡CCH2CH(SH)CH2CH2NH2 |
г) 3-винил-3-метилциклопропен |
|
|
г) HSCH2CH(C2H5)CH2CBr2CH2OH |
д) 2,4,6-триметилциклогексанкарбоновая кислота |
|
|
д) НООССН=СНСН2ССООН |
е) 2-бром-2-этилбутен-3-аль |
|
|
║ |
ж)2-хлор-3-аллилпентандиаль |
|
|
О |
11.Напишите структурные формулы всех возможных изомеров общей формулы |
|
|
е) H2NC(CH3)2CH2CH(F)CH=CHCH2NH2 |
С3Н6О3, назовите их по систематической номенклатуре. |
|
3. |
Напишите структурные формулы всех возможных изомеров общей форму- |
12.Дайте названия по систематической номенклатуре следующим соединениям, |
|
лы |
С3Н6О, дайте им названия по систематической номенклатуре, укажите, к |
укажите тип гибридизации атомов углерода и электронные эффекты заместите- |
|
каким классам органических соединений они относятся. |
лей в этих молекулах: |
|
|
4. |
Напишите структурные формулы всех возможных изомеров общей формулы |
а) НС≡ССН(С2Н5)СН2СН=СН2 |
|
С4Н6, дайте им названия по систематической номенклатуре, укажите тип гибри- |
б) HOOCCH2CH(SH)CH(OH)CH2COOH |
||
дизации атомов углерода в этих молекулах. |
в) СH3CH(CN)C(CH3)2COOH |
||
5. |
Напишите структурные формулы всех возможных изомеров кумола, дайте им |
г) СН2=С(Br)CH2CH=C=CHCH3 |
|
названия по систематической номенклатуре, укажите тип гибридизации ато- |
д) СН2=СНСН2ССН2СН(ОН)СН2СООН |
||
мов углерода в этих молекулах. |
║ |
|
|
6. |
Напишите структурные формулы следующих соединений и укажите элек- |
О |
|
тронные эффекты заместителей в этих молекулах: |
е) С2Н5ОСН(СН3)СН=С(CH3)CCH2OH |
||
|
а) 2,5-дибромгексен-1 |
|
║ |
|
б) 1-амино-3-хлорциклопентен-2 |
|
O |
|
в) 2-амино-4-этокси-6-фторбензальдегид |
ж)Н-ССН(ОН)СН=СНС-Н |
|
|
г) 3-нитро-4-аминоциклогексанол |
║ |
║ |
7. |
Дайте названия по систематической номенклатуре следующим соединениям, |
О |
О |
укажите тип гибридизации атомов углерода в этих молекулах, укажите элек- |
13.Напишите структурные формулы всех возможных изомеров общей формулы |
||
тронные эффекты заместителей в них: |
С3Н4, дайте им названия по систематической номенклатуре и укажите тип гибри- |
||
|
а) HC≡CCH(Cl)CH2CH=C(Cl)CH2CH2OH |
дизации атома углерода в этих молекулах. |
|
18
14.Напишите структурные формулы всех возможных изомеров 1-аллил-2-метил- бензола, дайте им названия по систематической номенклатуре, укажите тип гибридизации атома углерода в этих молекулах.
15.Напишите структурные формулы всех возможных изомеров общей формулы С4Н8О2, дайте им названия по систематической номенклатуре.
Кислотность и основность органических соединений
Кислотность – это способность соединения отдавать протон, т.е. способность к диссоциации. Чем легче протекает диссоциация, тем сильнее кислота.
К органическим соединениям, обладающим кислыми свойствами, относят карбоновые кислоты, фенолы и др.
В карбоновых кислотах и фенолах протон связан с кислородом. Чем больше отрицательный заряд на атоме кислорода, тем сильнее связь протон-кислород.
При этом труднее проходит диссоциация, и, следовательно, тем слабее кислота. И наоборот, чем меньше отрицательный заряд на кислороде, тем подвижнее протон, легче протекает диссоциация, а значит и сильнее кислота.
Рассмотрим влияние заместителей на кислотность карбоновых кислот.
H-COOH |
CH3-COOH |
CH3-CH2-COOH |
муравьиная кислота |
уксусная кислота |
пропионовая кислота |
В ряду следующих соединений - муравьиная кислота, уксусная кислота, пропионовая кислота кислотность уменьшается, т.к. около карбоксильной группы находятся алкильные группы, которые являются электронодонорами. Донорные группы подают электронную плотность на карбоксильную группу, при этом отрицательный заряд на атоме кислорода увеличивается, он сильнее «держит» протон, труднее протекает диссоциация и сила кислоты уменьшается. Чем объемнее радикал, тем больше его донорные свойства. Поэтому в данном ряду пропионовая кислота – самая слабая кислота.
При введении в радикал электроноакцепторных групп, электронная плотность оттягивается от карбоксильной группы в сторону акцептора, при этом отрицательный заряд на атоме кислорода уменьшается, протон становится подвижнее и сила кислоты увеличивается. Например, в ряду пропановая кислота, 2- хлорпропановая кислота и 2,2-дихлорпропановая кислота самой сильной кислотой является 2,2-дихлорпропановая кислота, т.к. атом хлора является электроноакцептором и таких групп здесь две.
СH3-CH2-COOH CH3-CH-COOH
Cl
пропановая кислота 2-хлорпропановая кислота
Cl
CH3-C-COOH
Cl
2,2-дихлорпропановая кислота
19
Таким образом, электронодонорные заместители уменьшают, а электроноакцепторные заместители увеличивают кислотность.
Рассмотрим кислотность фенолов. Электронная плотность оттянута от атома кислорода в сторону бензольного кольца.
В ряду п-аминофенол, фенол, п-нитрофенол кислотность увеличивается, т.к. аминогруппа является электронодонором, а нитрогруппа – электроноакцептором.
OH |
OH |
OH |
NH2 |
|
NO2 |
п-аминофенол |
фенол |
п-нитрофенол |
увеличение кислотности
Чем больше донорных групп входит в состав фенолов, тем меньше кислотность, чем больше акцепторных групп – тем больше кислотность.
Если сравнивать кислотность карбоновых кислот и фенолов, то любая карбоновая кислота сильнее, чем любой фенол, содержащий несколько акцепторных групп.
Основность – это способность соединения принимать протон.
К органическим соединениям, обладающим основными свойствами, относятся амины. Присоединение протона идет на неподеленную электронную пару атома азота. При этом, чем больше отрицательный заряд на атоме азота, тем легче происходит присоединение протона, следовательно, тем сильнее основание.
Если рядом с атомом азота находятся донорные группы, то отрицательный заряд на атоме азота увеличивается, а значит, увеличивается и основность. Например, в ряду аммиак, метиламин, диметиламин, основность увеличивается., т.к. увеличивается число донорных групп, связанных с атомом азота.
NH3 |
CH3-NH2 |
CH3-NH-CH3 |
аммиак |
метиламин |
диметиламин |
|
увеличение основности |
|
Основность анилина меньше, чем метиламина, т.к. электронная плотность в анилине оттянута от атома азота в сторону бензольного кольца.
