
Органическая химия.Казань
.pdf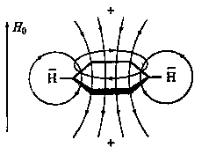
140
оценить можно. За основной фактор в этом случае принимается электронная плотность вокруг рассматриваемого протона: чем она выше, тем более экранирован протон электронами и тем в более сильном поле появится резонансный сигнал. И наоборот, чем больше электронная плотность смещена от протона, например под действием электроноакцепторных атомов и групп, т. е. чем больше протон дезэкранирован, тем в более слабом поле появится сигнал. Так, протоны метильных групп ацетона под влиянием расположенной рядом карбонильной группы имеют химический сдвиг 2,1 м. д., протоны дихлорометана и хлороформа, благодаря электроотрицательности атомов хлора, дают резонансные сигналы в еще более слабом поле (соответственно 5,3 и 7,3 м. д.) и т. д.
В табл. 3 приведены химические сдвиги протонов, входящих в различные фрагменты молекул. Протоны алканов резонируют в наиболее сильном поле (0,8 - 1,8 м.д.). Дезэкранирование протонов группы СН3, непосредственно связанной с электроноакцепторными заместителями (атомами галогенов, N- и О- содержащими группами), проявляется химическими сдвигами в более слабом поле (2,0 - 4,3 м.д.). Однако эти же электроноакцепторные группировки, удаленные от группы СН3 еще на одну ζ-связь, вызывают меньшее дезэкранирование (химические сдвиги в области 1,0-1,8 м. д.). Сильно дезэкранированы протоны, находящиеся при атомах углерода с двойными связями С=С и С=О, а также протоны ароматических циклов.
Т а б л и ц а 3. Химические сдвиги протонов при насыщенном атоме углерода*
|
|
|
|
|
|
H(R) |
|
|
|
|
H(R) |
|||||||
Группа X |
CH3—X |
R-CH2-X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
R CH2 C X |
||||||||||||
CH3 C X |
||||||||||||||||||
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
H(R) |
|
|
|
|
H(R) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
—Н |
0,2 |
|
0,9 |
0,9 |
|
|
1,3 |
|
|
|
||||||||
—Аr |
2,3 |
|
2,6 |
1,2 |
|
|
1,6 |
|
|
|
||||||||
—CH=CR2 |
1,7 |
|
2,0 |
1,5 |
|
|
1,0 |
|
|
|
||||||||
—C≡CR |
1,7 |
|
2,1 |
1,1 |
|
|
1,5 |
|
|
|
||||||||
—C≡ N |
2,0 |
|
2,3 |
1,3 |
|
|
1,6 |
|
|
|
||||||||
—CH=O |
2,2 |
|
2,4 |
1,1 |
|
|
1,6 |
|
|
|
||||||||
—COR |
2,1 |
|
2,4 |
1,0 |
|
|
1,5 |
|
|
|
||||||||
—COAr |
2,5 |
|
2,9 |
1,2 |
|
|
1,6 |
|
|
|
||||||||
—COOR |
2,1 |
|
2,2 |
1,1 |
|
|
1,7 |
|
|
|
||||||||
—I |
2,2 |
|
3,2 |
1,8 |
|
|
1,8 |
|
|
|
||||||||
—Br |
2,7 |
|
3,4 |
1,8 |
|
|
1,9 |
|
|
|
||||||||
—Cl |
3,0 |
|
3,4 |
1,5 |
|
|
1,8 |
|
|
|
||||||||
—F |
4,3 |
|
4,4 |
1,4 |
|
|
1,8 |
|
|
|
||||||||
—OR |
3,4 |
|
3,4 |
1,2 |
|
|
|
|
— |
|||||||||
—OAr |
3,8 |
|
3,9 |
1,3 |
|
|
1,5 |
|
|
|
||||||||
141
—OCOR |
3,6 |
4,1 |
|
1,2 |
1,6 |
—OCOAr |
3,8 |
4,2 |
|
1,5 |
1,7 |
—NR2 |
2,3 |
2,6 |
|
1,0 |
1,4 |
—NHCOR |
2,8 |
3,3 |
|
1,1 |
1,5 |
—NO2 |
4,3 |
4,4 |
|
1,6 |
2,0 |
—S R |
2,1 |
2,5 |
|
1,2 |
1,6 |
—SO2R |
2,8 |
2,9 |
|
1,3 |
1,7 |
* Приведены средние значения δ (м. д., в СС14 |
или CDC13) для выделенных |
||||
шрифтом протонов; R — алкил, Аr — арил.
Резонанс ароматических протонов имеет свои особенности. В этом случае внешнее магнитное поле Н0 индуцирует в π-электронной системе, например в молекуле бензола, кольцевой ток (рис. 8). Этот ток, в свою очередь, возбуждает вблизи протонов магнитное поле, усиливающее прилагаемое поле снаружи кольца. Происходит дезэкранирование протонов (на рис. 8 область экранирования обозначена знаком «минус») и поэтому для достижения резонанса необходимо более слабое поле Н0, в результате чего протоны дают резонансный сигнал в области более слабого поля (7,3 м. д.). Необычные значения химических сдвигов протонов ароматического ядра, как аренов, так и гетероциклов, являются одним из важнейших экспериментальных критериев ароматичности.
Рис. 8. Кольцевой ток и силовые линии магнитного поля в молекуле бензола
Сильное дезэкранирование вследствие полярности связи О—Н наблюдается для протонов карбоновых и сульфоновых кислот, что характеризуется химическими сдвигами в области 10 - 13 м. д. Однако это не означает, что в очень слабом поле резонируют только протоны кислотных групп. Так, в альдегидах, проявляющих очень слабые кислотные свойства, высокие значения химического сдвига протона группы СН=О (8,5-11 м.д.) объясняются дезэкранированием. Особую группу образуют сигналы протонов, связанных с гетероатомами (О, N, S), т. е. протонов гидроксильных групп спиртов и фенолов, меркаптогруппы тиолов, а также групп NH2 и NH аминов и амидов. Их положение в спектрах ПМР нехарактеристично (весьма широки диапазоны химических сдвигов), что в значительной степени связано с их

142
способностью образовывать водородные связи. Однако эти протоны можно легко идентифицировать по исчезновению их сигнала при съемке спектра в растворе (или с добавлением) тяжелой воды D2O. В этом случае происходит обмен водорода на дейтерий, как, например, у спиртов:
ROH + D2O (избыток) → ROD + HOD
Таким образом, величина химического сдвига может служить ориентировочной основой для установления структуры отдельных фрагментов молекулы. Особенно ценной является информация об алкильных фрагментах в молекуле, строение которых другими методами (например, ИК- и электронной спектроскопии) определить затруднительно. Метод ПМР дает обширную информацию о структуре неизвестного вещества.
По спектру ПМР можно определить:
-число типов неэквивалентных протонов (по общему числу сигналов);
-число протонов каждого типа (по интенсивности сигнала);
-ориентировочное положение протона в составе той или иной группы атомов (по химическому сдвигу);
-число протонов у соседних атомов углерода (по характеру расщепления сигнала);
-особенности пространственного расположения протонов и, следовательно, всей молекулы (по константе спин-спинового расщепления).
Во многих случаях, особенно когда имеются дополнительные сведения, например об элементном составе, или данные других спектральных методов, по спектру ПМР можно полностью установить структуру соединения.
Спин-спиновое взаимодействие
Картина спектра ПМР усложняется, если у соседних атомов углерода находятся неэквивалентные атомы водорода, хотя именно такое усложнение делает спектр более информативным для решения многих структурных задач.
Рассмотрим в спектре фрагмент молекулы >СНа—СНb< с двумя неэквивалентными атомами водорода На и Нь, химические сдвиги которых заметно отличаются. На протон На влияет магнитное поле, наведенное Нь за счет циркуляции его электронов. Это наведенное поле может быть направлено либо вдоль приложенного поля H0, либо против него. В результате этого протон На оказывается в двух различных полях, одно из которых несколько больше Но, а другое — меньше Но. Следствием этого является расщепление сигнала протона На на две линии, или дублет. Аналогичное расщепление наблюдается и для протона Нь. Следовательно, спектр будет содержать не одиночные пики (синглеты) протонов На и Нb, а два дублета сигналов (рис. 9). Влияние на магнитное экранирование протона другого неэквивалентного протона через валентные электроны называется спин-спиновым взаимодействием (спин-спиновым расщеплением). При удалении протонов друг от друга более чем на три связи этот эффект резко уменьшается.
143
Рис. 9. Спин-спиновое взаимодействие протонов Ha и Hb в системе АХ
Расстояние между линиями в расщепленном сигнале называется константой спин-спинового взаимодействия (КССВ), которая обозначается буквой J с подстрочными индексами расщепляемых протонов (например, Jab) и измеряется в герцах, а не в миллионных долях, так как не зависит от внешнего поля Но. Это обстоятельство очень важно, поскольку позволяет различать два отдельных синглета от сигнала в виде дублета. Для этого необходимо записать спектры при различных радиочастотах. Если интервал в герцах между пиками пропорционально изменится, значит, эти пики принадлежат разным синглетам, т. е. двум разным протонам, а не дублету одного протона.
При наличии в молекуле фрагмента >СН—СН2— протон группы СН будет взаимодействовать с обоими протонами группы СН2, и его сигнал расщепится на три линии, образовав триплет. Протон группы СН во фрагменте >СН—СН3 за счет спин-спинового взаимодействия с тремя эквивалентными протонами метильной группы дает сигнал, состоящий из четырех линий — квадруплет. В обоих рассматриваемых случаях протоны групп СН2 и СН3 проявятся в спектрах в виде дублетов как результат расщепления с протоном группы СН. В общем виде взаимодействие протона с п неэквивалентными ему протонами у соседнего атома углерода приводит к резонансному сигналу, состоящему из п + 1 пиков. Соотношение интенсивностей полос в дублете составляет 1:1, триплете 1 : 2 : 1 , квадруплете
1 : 3 : 3 : 1, квинтете 1 : 4 : 6 : 4 : 1 и т. д.
Таким образом, мультиплетность (множественность) сигнала протона несет информацию о том, сколько протонов находится с ним по соседству (а не о том, сколько протонов этот сигнал образуют). Для симметричных мультиплетных сигналов химические сдвиги даются по центру мультиплетов.
Константа спин-спинового взаимодействия
Наряду с химическим сдвигом и мультиплетностью сигнала информацию о строении молекулы дают также константы спин-спинового взаимодействия (КССВ). Значения этих констант варьируют в широких пределах (до 20 Гц) и зависят от магнитных свойств взаимодействующих протонов и их расположения в пространстве. Так, КССВ заметно различаются для протонов при двойной свя-

144
зи цис- и транс-изомеров алкенов, для орто-, мета- и пара-расположенных протонов в ароматическом ядре, а также для протонов, занимающих экваториальное или аксиальное положение в циклоалканах и родственных им соединениях:
H
С = С
H
J= 13-18 Гц
С = С 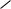 H H
H H
J= 6-12 Гц
Ha
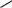 Hb
Hb
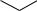

 Hc Hd
Hc Hd
Jab= 6-10 Гц Jac= 1-4 Гц Jad= 0-1 Гц
H1a

 H1e
H1e

 H2e
H2e
H2a
J1a, 2a= 6-12 Гц
J1a, 2e= 2-5 Гц
J1e, 2e= 2-5 Гц
Иллюстрацией привлечения КССВ для определения конфигурации атома С-1 аномерных гликозидов может служить сравнение их спектров ПМР.
|
H |
|
|
|
|
H |
|
|
|
|
||
|
|
|
CH OH |
O |
|
|
|
CH2OH |
O |
|
||
HO |
|
|
2 |
HO |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
H |
|
|
|
H |
|
|
|||
|
|
|
H |
|
|
|
H |
1 |
OR |
|||
|
|
|
|
H |
|
HO |
2 |
|||||
|
|
|
|
|
|
|||||||
|
HO |
|
|
|
|
OH |
||||||
|
|
|
OH |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
OR |
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
||
α – D-глюкопиранозид |
|
β-D-глюкопиранозид |
||||||||||
Достаточно сложные сами по себе спектры α- и β-D-глюкопиранозидов (с одинаковыми R) в основном будут схожими за исключением сигнала протона при атоме С-1. Важно даже не то, что химические сдвиги этих протонов будут несколько различными. Для обоих гликозидов сигнал протона при атоме С-1 представляет собой дублет за счет взаимодействия с протоном при атоме С-2. Но в случае α-аномера J1,2 составляет 2—4 Гц (как для аксиально-экваториальной пары), а у (β-аномера это значение достигает 8—10 Гц, что характерно для диаксиальной пары протонов.
4. Масс-спектрометрия
Метод масс-спектрометрии основан на регистрации ионов, возникающих при ионизации нейтральных молекул. Распространенным способом ионизации является электронный удар. Ионизация происходит при бомбардировке электронами с высокой энергией паров вещества при давлении 10-5 – 10-8 мм рт.ст. Когда энергия пучка электронов несколько превышает потенциал ионизации органических соединений (7-15 эВ), то при соударении молекула вещества теряет электрон и образует возбужденный катион-радикал, называемый молекулярным ионом.
145
М + е- → М+. + 2 е- молекула молекулярный
ион При действии пучка электронов с более высокой энергией (50-70 эВ) обра-
зующийся молекулярный ион обладает избытком энергии, что приводит к его распаду (фрагментации) с образованием осколочных ионов, ион-радикалов, радикалов, нейтральных частиц:
|
|
A1+ + Б1.( Б |
+ + A |
. |
) |
В+ + M |
... |
||||
|
|
||||||||||
+ . |
|
|
. |
1 |
|
1 |
|
|
2 |
||
|
+ |
|
+ |
|
. |
|
+ |
|
|
||
M |
|
A2 |
+ Б2 (Б2 |
|
+ A2 ) |
Г |
+ M3 |
... |
|||
|
|
||||||||||
|
|
A3+ |
.+ M1 |
|
|
|
|
|
Д+ |
+ Б3. |
... |
|
|
|
|
|
|
|
|||||
где А1+, А2+ (Б1+, Б2+) – первичные осколочные ионы; А3+. – осколочный ка- тион-радикал; В+, Д+ - вторичные осколочные ионы; А1·, А2·, Б1·, Б2· - радикалы; Г+ - перегруппировочный ион; М1, М2, М3 – нейтральные молекулы.
В масс-спектре регистрируются только ионы. Разделение ионов основано на различии в траекториях их движения в магнитном и (или) в электрическом полях. Положительно заряженные ионы разделяются в зависимости от отноше
ния массы к заряду (m/z), детектируются и регистрируются. Масс-спектры представляют в виде графика или таблицы. При графическом изображении на оси абсцисс приводят значения m/z, совпадающие с массой иона, так как в основном ионы однозарядны; на оси ординат – относительную интенсивность. Интенсивность максимального пика принимают за 100 %, интенсивность остальных пиков выражают в процентах по отношению к максимальному (существуют и другие способы представления интенсивности пиков).
Метод масс-спектрометрии характеризуется специфичностью и низким пределом обнаружения (можно анализировать несколько микрограммов вещества). Информативность повышается при сочетании масс-спектрометрии с другими методами исследования. В настоящее время для идентификации и структурного исследования лекарственных веществ и их метаболитов применяют хромато- масс-спектрометры, представляющие собой комбинацию хроматографа и массспектрометра.
Метод масс-спектрометрии широко применяется в органической химии для решения разнообразных задач.
Определение молекулярной массы
В этом случае в спектре идентифицируют пик молекулярного иона, так как масса молекулярного иона соответствует молекулярной массе анализируемого вещества.
При высоких энергиях ионизирующего пучка электронов вследствие фрагментации интенсивность пика молекулярного иона обычно невелика. Интенсив-

146
ный пик проявляется только в тех случаях, когда молекулярный ион стабилизирован за счет сопряжения или электронных эффектов заместителей. Так, интенсивный пик молекулярного иона наблюдается в спектрах ароматических соединений. В спектрах алканов, спиртов, кислот, аминов интенсивность пика этого иона мала или он даже отсутствует.
Если по масс-спектру невозможно определить пик молекулярного иона, то получают производные вещества (учитывают, что молекулярная масса при этом соотвественно увеличивается). Часто такой прием служит и для повышения летучести вещества. Соединения, содержащие аминогруппы, ацетилируют; спирты и кислоты переводят в сложные эфиры.
Для обнаружения в масс-спектре молекулярного иона можно руководствоваться следующими рекомендациями:
1) пик молекулярного иона должен обладать наибольшим массовым числом среди ионов спектра, за исключением изотопных пиков;
2)возникновение ионов в области масс, близких к молекулярному иону,
должно получить удовлетворительное объяснение за счет потери простейших нейтральных частиц и радикалов (СО, C2H4, H2O, NH3, HCN, H·, CH3·, Hal·);
3)пик молекулярного иона определен неверно, если потеря от 4 до 14 и от 21 до 25 атомных единиц массы приводит к возникновению интенсивных пиков ионов.
Идентификация органических соединений
Интерпретация масс-спектра заключается в отнесении основных пиков к определенным фрагментам молекулы и определении на этом основании структуры вещества. Фрагментация происходит за счет гомолитического и гетеролитического разрыва связей и включает перегруппировки, приводящие к образованию новых связей, которые отсутствуют в исходной молекуле. Вероятность фрагментации зависит от энергии соответствующей связи и возможности стабилизации осколочного иона.
Приступая к интерпретации пиков в масс-спектре, полезно провести прогнозирование вероятных путей фрагментации молекулы на базе ряда следующих общих закономерностей.
1. В насыщенных углеводородных цепях разрыв связи происходит преимущественно у наиболее замещенных атомов углерода, т.е. в соответствии со стабильностью образующихся катионов: третичные > вторичные > первичные. Если структура углеводорода такова, что отщепиться может несколько алкильных радикалов, то максимальным будет пик, обусловленный выбросом наибольшего из имеющихся радикалов. Например, для отщепляющихся метильного, этильно-
го и пропильного радикалов интенсивность пиков будет убывать в следующем порядке: [M – C3H7]+ > [M – C2H5]+ > [M – CH3]+.
147
2.В ненасыщенных соединениях происходит разрыв связи, находящейся в β-положении к кратной связи, бензольному кольцу или ароматическому гетероциклу, способствующим стабилизации образующегося катиона.
3.Для соединений, содержащих гетероатом, наиболее вероятным процессом фрагментации является разрыв углерод-углеродной связи у атома углерода, связанного с гетероатомом, с образованием ониевых ионов.
4.Соединения, содержащие карбонильную группу (альдегиды, кетоны, ки-
слоты, сложные эфиры, амиды), претерпевают расщепление с образованием относительно устойчивых ацильных ионов R-C≡O+.
В масс-спектрах многих соединений содержатся также ионы, происхождение которых нельзя объяснить только разрывом связей в молекулярном ионе. Причиной их появления служит внутримолекулярная перегруппировка в процессе фрагментации молекулярного иона.
О б у ч а ю щ и е з а д а ч и и у п р а ж н е н и я
Обучающая задача 1
Структурные изомеры — бензиламин и м-толуидин — имеют различные УФспектры. Соотнесите кривые 1 и 2 в УФ-спектрах, приведенных на рис. 10, со структурами бензиламина и м-толуидина.
|
|
CH3 |
|
.. |
.. |
СH -NH |
NH2 |
|
2 |
2 |
|
бензиламин |
|
м-толуидин |
Сопоставьте спектры этих соединений со спектром анилина (кривая 3), измеренного в растворе хлороводородной кислоты.
Решение. Основным хромофором в молекулах бензиламина м-толуидина является бензольное кольцо.
В бензиламине аминогруппа и бензольное кольцо разделены метиленовым звеном и не сопряжены друг с другом. В м-толуидине неподеленная пара электронов атома азота вступает в р,π-сопряжение с бензольным кольцом.

148 |
149 |
Рис. 10. УФ-спектры бензиламина, м -толуидина и хлорида анилиния
В УФ-спектре бензола в ближней УФ-области имеются две полосы поглощения - 204 (ε 8000) и 256 нм (ε 200) с тонкой колебательной структурой. Заместители в бензольном кольце, не вступающие с ним в сопряжение, вызывают незначительное батохромное смещение этих полос поглощения. На этом основании можно полагать, что кривая 2 принадлежит бензиламину. Кривая 1 соответствует УФ-спектру м-толуидина. Сопряжение аминогруппы с бензольным кольцом в молекуле м-толуидина приводит к батохромному смещению полос поглощения с увеличением их интенсивности, при этом колебательная структура «бензольной» полосы исчезает.
УФ-спектр анилина в кислой среде (см. рис. 10, кривая 3) практически совпадает со спектром бензиламина, но резко отличается от спектра м- толуидина. Кривая 3 отражает нарушение сопряжения аминогруппы с бензольным кольцом вследствие превращения анилина в кислой среде в ион анилиния C6H5NH3+, в котором неподеленная пара электронов атома азота выходит из сопряжения и предоставляется для связи с протоном кислоты.
Задачи для самостоятельного решения
1.Под действием УФ-облучения происходит изомеризация 3-фенилпропена
в1-фенилпропен. Определите, какая из кривых, приведенных на рис. 11, соответствует исходному соединению и какая — продукту изомеризации.
Рис. 11. УФ-спектры 3-фенилпропена и 1-фенилпропена
2.В УФ-спектрах 4-диэтиламинобензойной кислоты, снятых в этаноле, проявляется полоса поглощения с максимумом 288 нм (ε 19000), а в растворе хлороводородной кислоты — 270 нм (ε 10000). В чем причина различия в положении максимумов поглощения?
3.К какому типу электронных переходов относятся полосы поглощения 2,6- диметилгептадиен-2,5-она-4 с максимумами 260 нм (ε 24 000) и 380 нм (ε 80)? В каком направлении смещаются данные полосы поглощения при увеличении полярности растворителя?
Обучающая задача 2
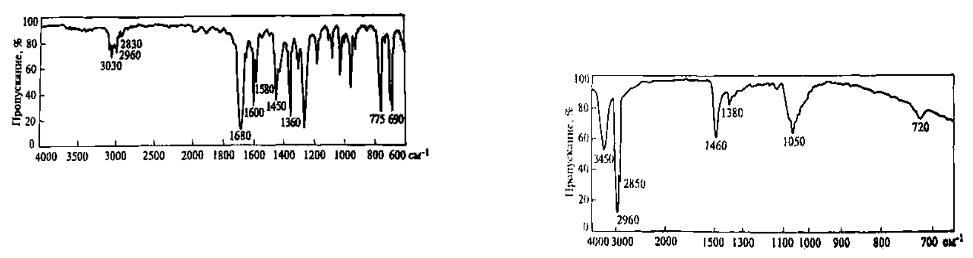
Проведите отнесение полос поглощения в ИК-спектре ацетофенона С6Н5—СО—СН3 (рис. 12) к колебаниям соответствующих функциональных групп и структурных фрагментов.
Р е ш е н и е . Задача состоит в обнаружении в ИК-спектре характеристических полос, обусловленных колебаниями отдельных связей групп атомов в молекуле ацетофенона. Пользуясь табл. 2 (стр.134), в молекуле ацетофенона выделяют связи, которые дают в ИК-спектре характеристические полосы,
а именно Сар—Н, Csp3—Н, Сар=-=Сар, С=О и находят диапазоны частот колебаний этих связей:
150
Связь |
Частоты колебаний, см-1 |
||
валентных |
деформационных |
||
|
|||
Сар—Н |
3100 –3000 |
~750, ~700 |
|
Csp3—Н |
2962-2853 |
1470-1430(ζas) |
|
|
1380—1360 (ζs) |
||
|
|
||
|
|
|
|
Сар=-=Сар, |
~1600, ~1580 |
- |
|
|
~1500, ~1450 |
||
|
|
||
|
|
|
|
С=О |
1700-1680 |
- |
|
|
|
||
Далее сравнивают положение теоретически предположенных полос с ИК-спектром ацетофенона (см. рис. 12), начиная с высокочастотной области (3700-2500 см-1). Можно полагать, что полоса 3030 см-1 вызвана валентными колебаниями Сар—Н, так как это подтверждается наличием двух полос деформационных колебаний этой же связи (775 и 690 см-1), характерных для монозамещенных производных бензола, и четырех обертонов в области 2000 - 1670 с м - 1 . Интенсивность и число полос, характерных для валентных колебаний кратных связей ароматического кольца, зависят от природы заместителей. В приведенном ИК-спектре колебания связи Сар=- =Сар, представлены в области «двойных связей» тремя полосами: 1600, 1580 и 1450 см-1. Следовательно, в ИК-спектре содержатся все полосы, характерные для монозамещенного бензольного кольца.
Рис. 12. ИК-спектр ацетофенона (жидкая пленка)
Полосы 2960 и 2830 см -1 можно считать результатом асимметричных валентных колебаний связей Сsp3 —Н в метильной группе. Соответствующие им деформационные колебания проявляются в виде двух полос при 1430 и 1360 см -1.
Интенсивная и потому легко узнаваемая полоса 1680 см-1является полосой валентных колебаний группы С=О (карбонильная полоса). Она характеристична по положению и чувствительна к взаимному влиянию атомов. В данном случае за-
151
счет π,π-сопряжения карбонильной группы и бензольного кольца увеличивается длина связи С=О и поэтому уменьшается частота ее валентных колебаний по сравнению с алифатическими кетонами.
Обучающая задача 3
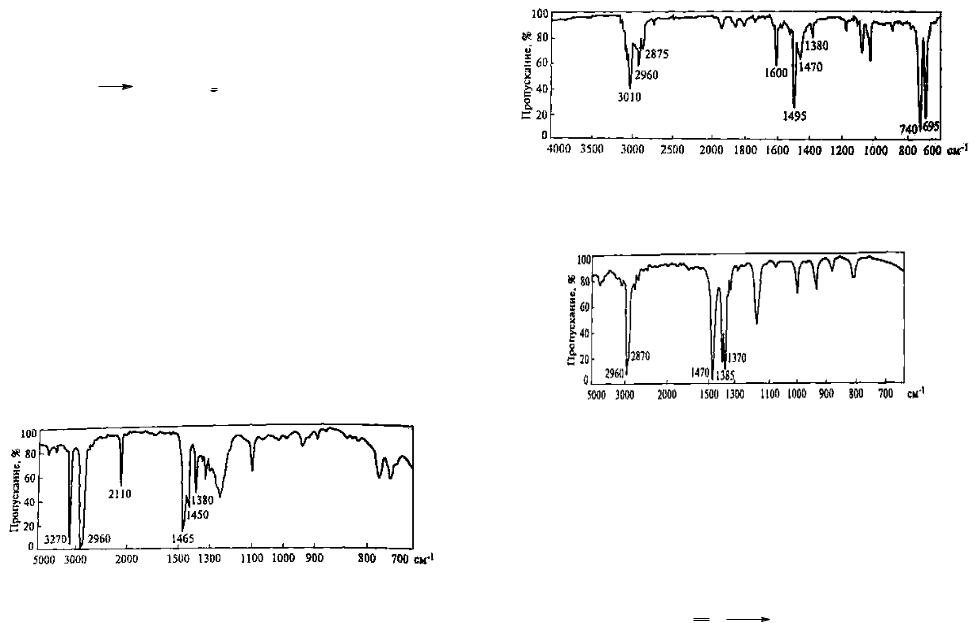
Из смеси, полученной в результате щелочного гидролиза спермацета, выделено низкоплавкое вещество состава С16Н34О. Выскажите предположение о структуре соединения по его ИК-спектру (рис. 13).
Р е ш е н и е . Полоса 3450 см-1 в высокочастотной области спектра может быть обусловлена валентными колебаниями связей N—Н или О—Н. В составе соединения отсутствует атом азота, поэтому данную полосу можно отнести к валентным колебаниям О—Н-группы, связанной водородной связью. Наличие в молекуле гидроксильной группы подтверждается тем, что в области 1200 - 1000 см-1наблюдается широкая полоса валентного колебания связи С—О при 1050 см-1. По данным табл. 2 эта полоса характерна для колебаний связи С—О в первичных спиртах.
Сложная полоса 2960 с м - 1 может быть связана с валентными колебаниями связей С—Н в алкановом фрагменте молекулы. Если это так, то в ИКспектре должны также проявляться полосы деформационных колебаний этих связей. Две наблюдаемые полосы 1460 и 1380 с м - 1 типичны для спектров алканов (см. табл. 2) и обусловлены асимметричными и симметричными деформационными колебаниями связей С—Н в группах СН3 и СН2. Полоса слабой интенсивности 720 с м - 1 соответствует маятниковым колебаниям метиленовой группы. Таким образом, можно считать, что ИК-спектр, представленный на рис. 12, принадлежит первичному алифатическому спирту.
Рис. 13. ИК-спектр соединения С16Н34О (жидкая пленка)
152
Обучающая задача 4
Какие характеристические частоты в ИК-спектре можно использовать для контроля за протеканием реакции каталитической дегидратации амида 2- метилпропановой (изомасляной) кислоты в ее нитрил?
CH3 |
- |
CH - CONH2 - H O |
CH3 - |
CH - C |
N |
|
|
2 |
|
|
|
|
CH3 |
CH3 |
|||
Р е ш е н и е . С помощью метода ИК-спектроскопии можно осуществить контроль за ходом реакции путем отбора проб или непрерывного наблюдения. Для этого следует выбрать характеристические полосы поглощения, являющиеся индивидуальными для исходного и конечного соединений, и фиксировать их изменение. За протеканием реакции, приведенной в условии задачи, можно следить по постепенному исчезновению двух полос поглощения аминогруппы — 3350 и 3170 см-1 (асимметричные и симметричные валентные колебания N—Н- связи амида) и полосы карбонильной группы 1640 см-1 (валентные колебания С—О-связи), а также по нарастанию полосы поглощения цианогруппы в нитриле — 2260 см-1 (валентные колебания С≡N).
Задачи для самостоятельного решения
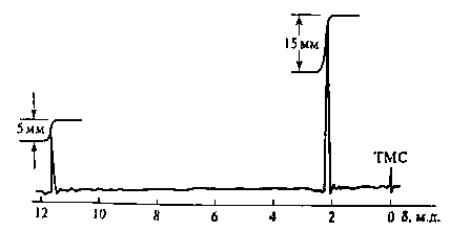
1. Соотнесите данные ИК-спектров (рис. 14 и 15) со структурами гексина-1 и толуола.
Рис. 14. ИК-спектр соединения (жидкая пленка)
153
Рис. 15. ИК-спектр соединения (жидкая пленка)
2. По характеристическим полосам поглощения выскажите предположение о структуре соединения, ИК-спектр которого представлен на рис. 16.
Рис. 16. ИК-спектр соединения (жидкая пленка)
3. В ИК-спектре вещества наблюдаются полосы 3300, 2950, 2860, 2120, 1465 и 1385 см-1. Какому из приведенных ниже соединений принадлежит этот спектр:
а) СН3СН2—СН=СН—СН2—СН=СН—СН3 б) СН3СН2СН2—С≡С—СН2СН2СН3 в) НС≡С—СН2СН2СН2СН2СН2СН3
г) СН3СН2—СН=СН—СН=СН—СН2СН
4. Какие характеристические частоты можно использовать для контроля за ходом реакции восстановления:
CH3CH O LiAlH4 CH3CH2OH
154
Обучающая задача 5
Вспектре ПМР уксусной кислоты (рис. 17) наблюдаются два сигнала протонов. Соотнесите эти сигналы со структурой соединения.
Ре ш е н и е . В спектрах ПМР соединений с неэквивалентными атомами водорода, и к тому же достаточно удаленными друг от друга (на четыре и более связи), наблюдаются сигналы каждого структурно отличающегося протона. Анализ спектра начинают обычно с выделения сигналов или групп сигналов, измерения химических сдвигов и интегральных интенсивностей. Интенсивность сигнала (под этим подразумевается площадь пика) пропорциональна числу протонов, дающих данный сигнал. Современные спектрометры ЯМР снабжены интегрирующим устройством, записывающим интенсивность сигналов в виде ступенчатой линии, как показано на рис. 17.
Вданном спектре наблюдается два сигнала - один (2,07 м. д.) принадлежит
протонам группы СН3, другой (11,5 м. д.) - сильно дезэкранированному протону карбоксильной группы (см. табл. 3, стр. 140). Высота подъема интегральной кривой соответствует площади каждого пика и показывает, что соотношение резонирующих протонов равно 3 : 1 (хотя это не указывает на число протонов).
Рис. 17. Спектр ПМР уксусной кислоты с приведением интегральной интенсивности сигналов
Следует отметить, что обратную задачу - по спектру установить структуру вещества - в данном случае однозначно не решить, так как протон с химическим сдвигом 11,5 м. д. может быть в составе не только карбоксильной группы, но, например, и сульфогруппы; протоны же с химическим сдвигом около 2 м. д. могут содержаться в самых различных по структуре молекулах (см. табл. 3, стр.140).
155
Обучающая задача 6
Установите структуру ациклического соединения состава С3Н6О2, спектр ПМР которого характеризуется двумя сигналами равной интенсивности с химическими сдвигами 2,1 и 3,7 м. д.
Р е ш е н и е . Соотношение атомов углерода и водорода в молекуле говорит о наличии двойной связи (С=С или С=О). Фрагмент С=О присутствует в таких классах органических соединений, как альдегиды, кетоны, карбоновые кислоты, сложные эфиры. Из этого перечня следует сразу исключить пропионовую кислоту и альдегиды (с дополнительной кислородсодержащей функцией), так как протоны групп СООН и СНО дают сигналы в очень слабом поле (более 8,5 м. д.). Сигналу с химическим сдвигом 2,1 м. д. могут отвечать протоны группы СН3С=О. Сигнал с химическим сдвигом 3,7 м. д. может свидетельствовать о наличии фрагмента СН—О— или гидроксильной группы. Указанные фрагменты содержатся в молекуле гидроксиацетона СН3СОСН2ОН, однако здесь присутствуют три типа протонов, которые дали бы в спектре три сигнала. Из двух сложных эфиров состава С3Н6О2
— этилформиата НСООСН2СН3 и метилацетата СН3СООСН3 — первый также не удовлетворяет условиям задачи, так как содержит три типа протонов, причем один из них должен обнаруживаться в очень слабом поле (как и альдегидный). Метилацетат содержит неэквивалентные протоны групп СН3С=О (2,1 м. д.) и СН3О (3,7 м. д.), дающие сигналы равной интенсивности.
Соединения состава С3Н6О2 со связью С=С обязательно будут содержать либо гидроксильную группу при двойной связи, либо две гидроксильные группы при одном атоме углерода (напишите эти две структуры самостоятельно). Такие соединения, как известно, неустойчивы. Следовательно, единственной структурой, согласующейся сданными спектра ПМР, является метилацетат.
Обучающая задача 7
Проведите отнесение сигналов в спектре ПМР этилацетата СН3СООСН2СН3 (рис. 18) и укажите, чем будет отличаться спектр изомерного ему метилпропионата СН3СН2СООСН3.
Решение. Основываясь на данных табл. 3, можно по величине химических сдвигов заключить, что сигнал а относится к протонам метильной группы фрагмента CH3CH2O, сигнал б укладывается в область химических сдвигов протонов группы СН3С=О, а сигнал в соответствует группе СН2 фрагмента СООСН2СH3.
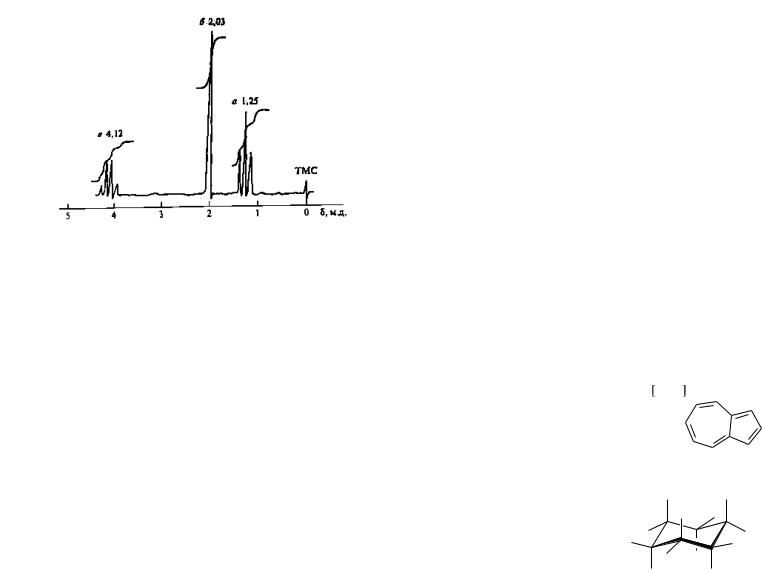
156
Рис. 18. Спектр ПМР этилацетата
Анализ мультиплетности сигналов в приведенном спектре полностью решает поставленную задачу. Так, протоны ацетильной группы СН3С=О, не взаимодействующие с остальными протонами, дают нерасщепляющийся сигнал — синглет. Таковой в спектре присутствует, это сигнал б. Протоны групп СН3 и СН2 этильного радикала оказывают друг на друга взаимное влияние и дают мультиплетные сигналы системы А2Х3: в группе СН3 каждый протон характеризуется триплетом, так как взаимодействует с двумя протонами группы СН2, а протоны группы СН2 дают сигнал в виде квадруплета вследствие взаимодействия с тремя протонами группы СН3. Следовательно, сигнал в принадлежит группе СН2, а сигнал а — группе СН3 этильного радикала. Приведенному отнесению удовлетворяет и интегральная кривая, показывающая соотношение интенсивностей сигналов а: б: в, равное 3 : 3 : 2 .
Изомерный этилацетату метилпропионат также содержит метильную и этильную группы. Но в наиболее слабом поле будет наблюдаться сигнал группы СН3О и виде синглета. Протоны метиленовой группы дадут резонансный сигнал — квадруплет, а протоны метильной группы фрагмента СН3СН2С=О — триплет в наиболее сильном поле. Нарисуйте самостоятельно этот спектр, принимая во внимание следующие значения химических сдвигов: 1,2; 2,4 и 3,7 м. д.
Задачи для самостоятельного решения
1. На основании химических сдвигов (см. табл. 3) и характера расщепления сигналов объясните, как с помощью спектроскопии ПМР можно различить соединения в следующих группах: а) бензол, тол у- ол, кумол; б) диметиловый эфир, диэтиловый эфир, ацетон.
2. Укажите, с помощью каких параметров спектров ПМР можно
различить |
уксусную, |
пропионовую, |
масляную |
и |
бензойную |
кислоты. |
|
|
|
|
|
157
3. В спектре ПМР смеси бензола и циклогексана содержатся два сигнала (1,4 и 7,3 м. д.) с соотношением интенсивностей 2 : 1. Определите количественный состав смеси.
4.С помощью спектроскопии ПМР докажите, что в результате
взаимодействия ацетилхлорида СН3СОС1 с метанолом образовался метилацетат.
5.В спектре ПМР неизвестного соединения имеется сигнал с химическим сдвигом 10,5 м. д. Можно ли на этом основании сделать вывод, что соединение является альдегидом, но не карбоновой кислотой или кетоном?
СЛОВАРЬ ОСНОВНЫХ ТЕРМИНОВ
А
Аддукты – молекулярные комплексы и соединения, образующиеся в результате реакций присоединения (от англ. addition - присоединение).
Азогруппа – атомная группировка –N=N- , где оба атома азота находятся в sp2-гибридном состоянии.
Азокрасители – органические вещества, характеризующиеся наличием в молекулах одной или нескольких азогрупп, связанных преимущественно с ароматическими или гетероциклическими радикалами (реже – алифатическими радикалами).
Азосочетание – взаимодействие ароматических солей диазония с фенолами или ароматическими аминами, приводящее к образованию азосоединений.
Азулены – конденсированные системы, состоящие из циклопентадиена и циклогептатриена (бицикло 5,3,0 декапентаены):
Аксиальное и экваториальное положение – термины, которыми обозна-
чают пространственное расположение атомов относительно цикла в молекулах.
a |
|
a |
|
a |
|
e |
|
e |
a |
e |
|
e |
|||
e |
|||
|
|||
e |
|
||
|
|
||
a |
|
a |
|
|
|
Алифатические соединения – соединения, в которых атомы углерода, соединяясь между собой, образуют открытые разветвленные или неразветвленные цепи.
Алициклические соединения – соединения, в молекулах которых атомы углерода образуют циклические цепи. Сюда не относятся ароматические соединения.
158
Алкилирование по Фриделю-Крафтсу – введение алкильного заместителя в ароматическое кольцо в реакции арена с алкилгалогенидами в присутствии катализатора.
|
CH3 |
+ CH3Cl AlCl3 |
+ HCl |
Алкилирующие реагенты – соединения, используемые для введения алкильных групп. К числу алкилирующих реагентов относятся алкилгалогениды, алкены, спирты, алкилсульфаты и т.д.
Алкоголяты – группа химических соединений, представляющих собой продукты замещения атома водорода в ОН-группе спиртов на металл.
Na + C2H5OH C2H5ONa + ½ H2
Альдольная конденсация – взаимодействие двух одинаковых или разных альдегидов или кетонов, содержащих α-CH-кислотный центр.
|
|
|
|
|
O |
O |
|
|
|
|
OH |
R' |
O |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
R |
|
CH2 |
|
C |
+ R' |
|
CH2 |
|
C |
|
R |
|
CH2 |
|
CH |
|
CH |
|
C |
|
||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
H |
H |
|
|
|
|
|
|
|
|
|
|
|
H |
||||
Аминирование – введение аминогруппы в молекулу органического соединения.
C2H5Cl + 2 NH3 → C2H5NH2 + NH4Cl
Антиподы оптические – пара энантиомеров, вращающих плоскость поляризованного света на одну и ту же величину, но в противоположных направлениях.
Антиоксиданты – вещества, оказывающие тормозящее (ингибирующее) влияние на процессы окисления кислородом.
Ароматичность – совокупность свойств, отражающих структурные и энергетические особенности, а также реакционную способность плоских циклических систем, содержащих (4n+2) π-электронов, которые вовлечены в замкнутую цепь сопряжения. Ароматичность характеризует повышенную термодинамическую устойчивость ароматического соединения, обусловленную делокализацией π-электронов.
Ароматические соединения – соединения циклической структуры, в которых все атомы, участвующие в формировании цикла, вносят вклад в образование единой делокализованной π-электронной системы, включающей в соответствии с правилом Хюккеля (4n+2) π-электронов.
Асимметрический атом (хиральный центр) – атом, связанный с четырь-
мя различными атомами или группами атомов.
Асимметрический синтез – способ получения оптически активных соединений; реализуют с помощью реакций, в результате которых из оптически неактивных исходных соединений формируются молекулы с хиральным центром (чаще всего с асимметрическим атомом углерода).
159
Ахиральная молекула – молекула, совместимая со своим зеркальным изображением. Такая молекула симметрична и характеризуется наличием центра или плоскости симметрии.
Ацеталь – продукт присоединения 2х моль спирта к альдегиду.
|
|
|
O |
|
|
OR' |
|||
|
|
|
|
|
|
|
|
|
|
R |
|
C |
+ 2R'OH |
|
|
|
|
|
|
|
R |
|
C |
|
OR' |
||||
|
|
|
|||||||
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||
Ацил – остаток карбоновой кислоты:
O
R C
Ацилирование – процесс введения ацильной группы в молекулу органического соединения. В качестве ацилирующих реагентов преимущественно используются карбоновые кислоты, их ангидриды и галогенангидриды. Различают O-, N-, C- и S-ацилирование в соответствии с тем, по какому атому происходит присоединение ацильной группы.
Б
Бейльштейна проба – способ обнаружения галогенов в органических соединениях. Прокаленную медную спираль, покрытую оксидои меди (II) и не окрашивающую пламя горелки, погружают в раствор анализируемого вещества и затем вновь вносят в бесцветное пламя горелки. Если исходное вещество содержит галоген, то образующиеся при прокаливании летучие галогениды меди окрашивают пламя в зеленый или голубовато-зеленый цвет. Б.П. чувствительна, но не позволяет различать галогены.
R-Hal + CuO → CuHal2 + CO2 + H2O
Барбитуровая кислота – 2,4,6-триоксопиримидин характеризуется высокой СН-кислотностью в положении 5. Получают взаимодействием мочевины с малоновым эфиром или малоновой кислотой.
O
|
|
|
|
|
|
|
|
H |
H |
|
N1 6 |
5 |
|||||
|
|
|
2 |
|
|
|
4 |
H |
|
|
|
3 |
|
||||
O |
|
|
|
O |
||||
|
|
N |
|
|||||
|
|
|
|
|
|
|||
H
Бензохиноны – циклические дикарбонильные соединения, представляющие собой изомерные структуры – 1,4-бензохинон и 1,2-бензохинон.
O O
O
O
