
Органическая химия.Казань
.pdf
100
Гидролиз АТФ до АДФ (аденозиндифосфорной кислоты)
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
NH2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|||||
O |
O O |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
HO-P-O-P-O-P |
-O-CH2 |
|
O |
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH OH OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ H2O |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
H |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
H |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
АТФ |
|
|
|
|
|
|
|
|
|
|
N |
|
|
NH2 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
O O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
N |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
HO- |
P-O-P-O-CH2 |
O |
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
OH OH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
+ H3PO4 |
|||||||||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
OH |
|
|
|
|
|||||||||
АДФ
Наиболее важными представителями никотинамиднуклеотидов являются никотинамидадениндинуклеотид (NAD, или в русской литературе НАД) и его фосфат (NADP, или НАДФ). Эти соединения выполняют важную роль коферментов большого числа ферментов дегидрогеназ и, следовательно, являются участниками окислительно-восстановительных реакций. В соответствии с этим, они могут существовать как в окисленной (НАД+, НАДФ+), так и восстановленной (НАДН, НАДФН) формах.
|
|
101 |
|
|
|
|
Никотинамид |
|
|
|
Аденин |
|
|
|
|
|
|
|
||
O |
|
|
|
NH2 |
|
|
C |
|
|
N |
N |
|
|
NH2 |
|
|
||||
|
|
|
||||
|
|
|
|
|||
+ |
O |
O |
N |
|
|
|
N |
|
N |
NH2 |
|||
CH2O P O P-O-CH2 |
||||||
|
|
|
|
|||
OH HO |
OH |
OH |
O |
|
|
|
|
|
|
||||
|
|
|
|
|
||
O |
|
|
|
|
|
|
OH OR
R=H Никотинамидадениндинуклеотид (НАД+)
R=PO3H2 Никотинамидадениндинуклеотидфосфат (НАДФ+)
H H |
O |
|
|
|
NH2 |
|
|
|
|
|
|
||
|
C |
|
|
N |
N |
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
O |
O |
N |
|
|
|
|
N |
NH2 |
|||
|
|
|
||||
|
CH2O |
P O P-O-CH2 |
|
|
||
|
O |
|
|
|||
OH HO |
OH OH |
|
|
|||
|
|
|
||||
 O
O
OH OR
R=H Никотинамидадениндинуклеотид (НАДH)
R=PO3H2 Никотинамидадениндинуклеотидфосфат (НАДФH)
Типичными примерами биохимических реакций с участием НАД+ служат окисление спиртовых групп в альдегидные (например, превращение ретинола в ретиналь), а с участием НАДН – восстановление карбонильных групп в спиртовые (например, превращение пировиноградной кислоты в молочную).
Лекарственные средства нуклеиновой природы
При лечении некоторых опухолевых заболеваний в качестве лекарственных средств используют синтетические производные пиримидинового и пуринового рядов, по строению похожие на естественные метаболиты (в данном случае - на нуклеиновые основания), но не полностью им идентичные, а являющиеся анти-
102
метаболитами. Задача такого синтетического вещества состоит в подмене метаболита в естественных биореакциях. Антиметаболиты должны быть способны лишь частично выполнять в организме функции метаболитов. Например, 5- фторурацил выступает в роли антагониста урацила и тимина, 6-меркаптопурин
– аденина. Конкурируя с метаболитами, они нарушают на разных этапах синтез нуклеиновых кислот в организме.
|
O |
|
SH |
|
|
|
F |
|
|
H N |
|
N |
|
N |
|
|
|
|
|
O |
N |
|
N |
N |
|
H |
|
H |
|
|
|
|
5-фторурацил 6-меркаптопурин
Являясь химическими имитаторами метаболитов, лекарственные вещества такого рода «обманывают» контролирующие ферментные системы, встраиваются в метаболическую схему и заменяют собой настоящий метаболит, например, в рвстущей цепочке ДНК или РНК; для торможения роста и развития патогенных вирусов при создании ацикловира – высокоэффективного антигерпесного препарата (герпес – вирусные заболевания с характерным высыпанием сгруппированных пузырьков на коже и слизистых оболочках).
OH
N 
 N
N
H2N 
 N
N N
N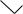 O
O
 OH
OH
ацикловир
Важной характеристикой синтетических антиметаболитов является то, что они обладают малой токсичностью и не оказывают нежелательных побочных эффектов благодаря высокой степени их узнаваемости системами организма, для которых эти лекарственные вещества структурно «выглядят» почти не чужеродными, биогенными.
У п р а ж н е н и я 1. Напишите реакцию образования нуклеотида из 2-дезоксирибозы, цито-
зина и фосфорной кислоты. Дайте название этому веществу.
2.Изобразите водородные связи между парами комплементарных оснований: аденин – урацил, тимин – аденин. Какое из этих нуклеиновых оснований не встречается в ДНК, а какое – в РНК?
3.Напишите реакцию полного ступенчатого гидролиза АТФ. Назовите продукты всех стадий.
4.Напишите реакцию образования нуклеозида из рибозы и гуанина. Дайте название этому веществу.
5.Напишите реакцию образования дезоксиуридин-3-фосфата. Укажите гликозидную связь. В чем состоит несоответствие этого вещества природным нуклеотидам и нуклеиновым кислотам?
103
6.Напишите все возможные таутомерные формы для гуанина.
7.Напишите реакцию ступенчатого гидролиза риботимидин-5-фосфата. Назовите продукты всех стадий. В чем состоит несоответствие этого вещества природным нуклеотидам и нуклеиновым кислотам?
8.Напишите все возможные таутомерные формы для цитозина.
9.Изобразите водородные связи между гуанином и цитозином.
10.Напишите последовательность нуклеиновых оснований, комплементарную следующей: А – Ц – Г – У – А – А – Г – Ц – У – У – Г – А – Ц . К каким нуклеиновым кислотам относится эта последовательность?
11.Напишите все возможные таутомерные формы для аденина. 12.Напишите реакцию образования дезоксиаденозин-5-фосфата. Укажите
гликозидную связь.
13.Напишите все возможные таутомерные формы для тимина.
14.Напишите реакцию ступенчатого гидролиза дезоксигуанозин-3-фосфата. Назовите продукты всех стадий.
15.Напишите все возможные таутомерные формы для урацила.
16.Напишите последовательность нуклеиновых оснований, комплементарную следующей: Ц – А – Т – А – Г – Т – Г – Ц – Ц – А – Т – Г – А . К каким нуклеиновым кислотам относится эта последовательность?
Низкомолекулярные биорегуляторы
Низкомолекулярные биорегуляторы - весьма многочисленная группа физиологически активных соединений, как природных, так и синтетических, выполняющих разнообразные функции в организмах человека и животных, в растениях и микроорганизмах. К ним относятся алкалоиды, витамины, терпеноиды, антибиотики, стероиды, феромоны, простагландины, природные токсины, лекарственные препараты, пестициды и др. Объединение таких веществ в единую группу во многом условно и базируется в основном на сравнительно небольшой молекулярной массе этих соединений. Другими словами, подчеркивается их отличие от биополимеров - белков, нуклеиновых кислот, полисахаридов, хотя, конечно, четкую грань между этими группами провести практически невозможно ни с химической, ни с биологической точек зрения. Такое подразделение оправдано исторически и методически, так как алкалоиды, витамины, терпеноиды и стероиды были первыми объектами химии природных веществ, строение которых было расшифровано, а синтез этих соединений достиг немалых успехов уже к началу нашего столетия.
Стероиды
Кстероидам относится большая группа биологически важных соединений,
воснове структуры которых лежит скелет стерана (гонана)
(циклопентанопергидрофенантрена):
104
Пергидрофенантрен
Циклопентан
Декалин C D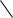
A B
Стеран
( Циклопентанопергидрофенантрен)
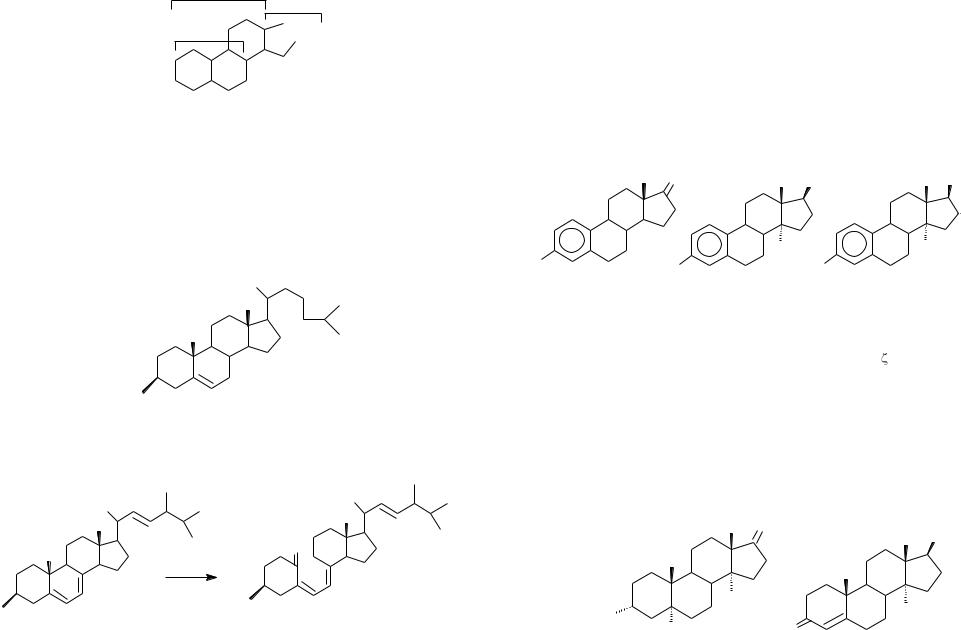
Среди стероидов - половые гормоны, сердечные гликозиды, желчные кислоты, витамины, алкалоиды, регуляторы роста растений. Свое начало стероиды берут от стеринов - алициклических липидоподобных веществ природного происхождения. Наиболее известный среди стеринов - холестерин, содержащийся почти во всех тканях животного организма. Особенно много холестерина в центральной и периферической нервных системах, кожном сале, почках и т.п.; так называемые желчные камни иногда на 90% состоят из холестерина (от греч.

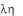 - желчь и
- желчь и 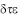
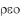
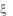 - твердый). Метаболизм холестерина играет важную роль в организме - при некоторых патологических отклонениях, например, при атеросклерозе, холестерин откладывается на стенках кровеносных сосудов.
- твердый). Метаболизм холестерина играет важную роль в организме - при некоторых патологических отклонениях, например, при атеросклерозе, холестерин откладывается на стенках кровеносных сосудов.
СН3
СН3
НО
Холестерин (холестерол)
Среди других стеринов следует упомянуть эргостерин - предшественник витамина D.
|
СН3 |
|
|
СН3 |
|
СН3 |
CH2 |
|
hv |
||
|
||
НО |
НО |
|
|
||
Эргостерин |
Кальциферол (витамин D2 ) |
105
Половые гормоны
Важнейшие среди стероидных гормонов - женские (эстрогены) и мужские (андрогены). Половые гормоны необходимы для нормального развития и функционирования половых органов, развития вторичных половых признаков и продолжения жизни.
Эстрогены объединяют группу производных эстрана, имеющих ароматическое кольцо А. Впервые эстрогены обнаружены Б.Зондеком (Германия) в 1927 году. Позднее в 1929 - 1932 годах А. Бутенандт (Германия) выделил в кристаллическом состоянии гормон, названный им эстроном (от англ. Oеstrus - течка). В этот же период Е.А. Дойзи (США) выделил два других эстрогена - эстрадиол и эстриол.
CH3 O |
CH3 OH |
CH3 OH |


 OH
OH
|
H |
H |
HO |
HO |
HO |
|
||
Эстрон |
Эстрадиол |
Эстриол |
Эстрогены используются для лечения половой недостаточности, при климактерических расстройствах, гипертонии, онкологических и других заболеваниях.
Мужские половые гормоны - андрогены (от греч. 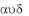
 - мужской,
- мужской, 
 - образовывать) наряду с влиянием на эндокринную систему человека, обладают сильным анаболическим эффектом. Их недостаток приводит к нарушениям азотистого и фосфорного обменов, атрофии скелетной мускулатуры и другим расстройствам.
- образовывать) наряду с влиянием на эндокринную систему человека, обладают сильным анаболическим эффектом. Их недостаток приводит к нарушениям азотистого и фосфорного обменов, атрофии скелетной мускулатуры и другим расстройствам.
В 1932 году А. Бутенандт (Германия) выделил из мочи человека первый андроген - андростерон . Позднее в 1935 году Э. Лакье (Германия) показал, что это соединение является метаболитом, а истинный мужской половой гормон - тестостерон, содержащийся в тестикулах.
CH3 O
CH3 OH
CH3 |
CH3 |
|
|
|
H |
HO |
|
H |
|
O |
|
|
H |
|
|
|
Андростерон Тестостерон
106
Наличие ароматического цикла А в женских половых гормонах определяет основное различие в химических свойствах эстрогенов и андрогенов. Женские половые гормоны хорошо растворимы в щелочах за счѐт гидроксильной группы, находящейся при бензольном кольце:
|
CH3 OH |
CH3 OH |
|
C D |
+ H O |
|
NaOH |
|
|
2 |
|
A |
B |
|
HO |
|
NaO |
В реакцию со щелочными металлами вступают все гидрокси-группы, имеющиеся в молекуле.
Химические свойства стероидов обусловлены наличием в молекуле той или иной функциональной группы. Например, в молекуле холестерина имеются -ОН группа и двойная связь, следовательно будут иметь место реакции, характерные для вторичных спиртов и непредельных соединений:
|
|
|
CH3 |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
H2O/KMnO4 |
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
CH3 |
|
|
|
|
|
|
|
|
CH3 |
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
HO |
|
|
|
|
|
|
K |
HO |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
OHOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
|
CH3 |
|
|
|
|
|
|
|
|
|
+ H2 |
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
KO |
|
|
|
|
|
Присутствиe оксо ( С=О) группы в некоторых половых гормонах предполагает наличие всех свойств, присущих кетонам:
107
CH3 |
O |
CH |
3 |
OH |
|
|
|
||
|
|
|
|
CN |
|
|
HCN |
|
|
HO |
|
HO |
|
|
Терпены
Класс терпеноидов или изопреноидов составляет большая группа биологически активных соединений, молекулы которых построены на основе остатков молекул изопрена (С5Н8):
|
|
CH = C _ CH = CH2 |
CH |
|
|
|||||
|
|
2 |
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
изопрен |
|
|
||||
В зависимости от числа изопреновых звеньев, входящих в состав молекулы |
||||||||||
терпены и их производные делятся на следующие группы: |
|
|
||||||||
С10Н16 - монотерпены; |
|
|
С30Н48 - тритерпены; |
|||||||
С15Н24 - сесквитерпены; |
|
|
С40Н64 - тетратерпены; |
|||||||
С20Н32 - дитерпены; |
|
|
С50Н80 - политерпены. |
|||||||
Мы ограничимся рассмотрением монотерпеноидов. |
|
|
||||||||
В большинстве терпенов изопреновые фрагменты соединены друг с другом |
||||||||||
по принципу |
голова к хвосту - изопреновое правило: |
|
|
|||||||
CH |
3 |
CH3 |
|
|
CH3 |
CH2 |
||||
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хвост |
голова |
|
|
|||
В зависимости от строения углеродного скелета различают ациклические и циклические монотерпены.
Среди монотерпенов (С10Н16) наиболее распространены моно- и бициклические терпены. Многие из них известны с давних пор и использовались в Древнем Египте для бальзамировании. Летучие масла растений, получившие в тот период известное название Quinta essentia (аромат растений) обязаны своими парфюмерными свойствами присутствию в них соединений этого класса. Наиболее известными представителями монотерпенов являются:
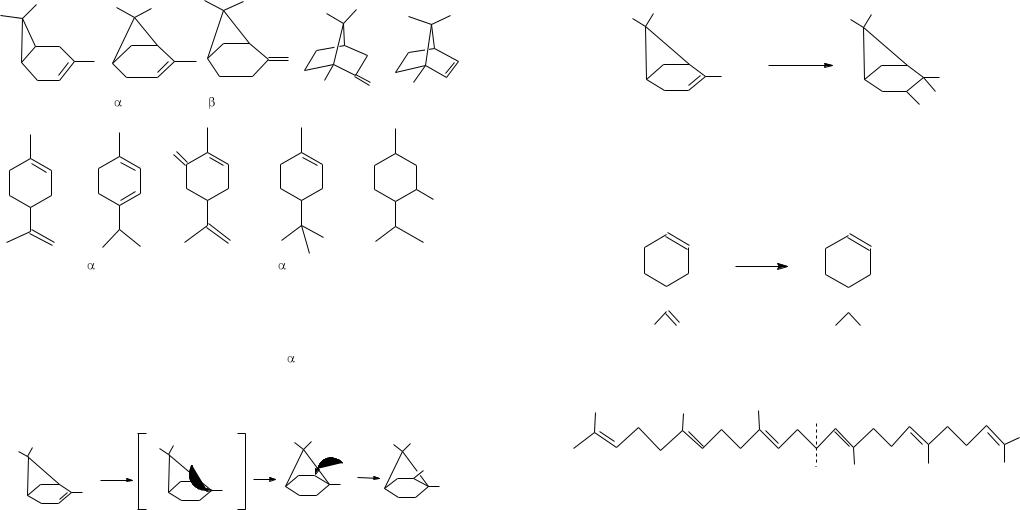
108
O
3-карен |
- пинен |
-пинен |
камфора |
борнилен |
O
OH
OH
лимонен |
-терпинен |
карвон |
-терпинеол |
ментол |
Химические свойства этого класса соединений обусловлены как наличием в них определенных функциональных групп, так и склонностью некоторых терпенов к изомерным превращениям.
Наиболее известным изомерным превращением в ряду терпенов является перегруппировка Вагнера-Меервейна в реакции - пинена с хлороводородом, которая заключается в переходе менее устойчивого четырехчленного цикла (пинановая система) в устойчивый пятичленный цикл (борнановая система).
H C CH3 |
H3C |
CH |
|
H3C CH3 |
|
H C CH3 |
3 |
|
|
|
3 |
||
3 |
|
|
|
|
|
|
|
HCl |
|
|
|
Cl - |
Cl |
|
|
|
|
|
||
|
|
|
+ |
|
|
|
|
|
+ |
|
CH3 |
CH |
|
CH |
|
CH3 |
|
|||
3 |
|
|
|
3 |
||
|
|
|
|
|
|
При этом известная реакция Вагнера (Н2О, КMnO4) протекает по иному механизму без изомеризации скелета молекулы:
|
|
109 |
|
H3C |
CH3 |
H3C |
CH3 |
|
|
||
|
|
H2O, KMnO4 |
|
|
CH3 |
|
CH3 |
|
|
|
OH |
|
|
|
OH |
Если в молекуле терпена имеется гидрокси - группа (ментол), то будут иметь место все реакции, характерные для спиртов, если - оксо - группа (камфора) - все реакции, присущие кетонам. Лимонен, содержащий 2 двойные связи, будет вступать в реакцию в первую очередь по внешней двойной связи в соответствии с правилом Марковникова:
|
CH3 |
|
CH3 |
|
|
||
|
|
|
|
HCl
|
|
|
|
Cl |
|
H3C CH2 |
|||||
|
|
||||
H3C CH3 |
|||||
Одним из важнейших представителей класса ациклических терпенов является тритерпен сквален, образующийся в качестве промежуточного продукта в процессе биосинтеза холестерина:
Сквален
Ментол применяют как наружное болеутоляющее и как антисептик при воспалительных заболеваниях верхних дыхательных путей. Кроме того, его используют и как спазмолитик при стенокардии (под названием валидол, который состоит из смеси 25 % ментола и 75 % ментилового эфира изовалериановой кислоты). Ментол обладает чистым мятным запахом, холодящим вкусом, и его используют также для ароматизации пищевых продуктов и зубной пасты.
Каротиноиды
Особую группу соединений, которые построены по тому же принципу что и терпеновые молекулы, составляют каротиноиды - растительные пигменты.
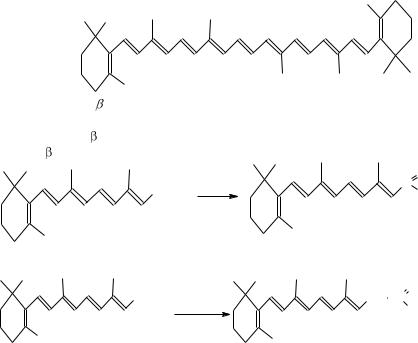
110
Многие из этих соединений играют роль витаминов или их предшественников, а также участвуют в фотосинтезе.
- каротин (черточками обозначены - СН3 группы)
Молекула - каротина симметрична и состоит из двух одинаковых фрагментов. - каротин является предшественником витаминов группы А:
|
C |
O |
CH2OH [O] |
H |
ретинол ( витамин А1) |
ретиналь |
|
O |
CH2OH |
CH2 OC |
CH3COOH |
CH |
|
3 |
H2O |
|
ретинол ( витамин А1) |
ретинолацетат (витамин А) |
Известно несколько витамеров витамина А: ретинол, ретиналь, ретиноевая кислота.
Витамин А1 (ретинол) выделен впервые из рыбьего жира. Название ретинол связано с химическими реакциями с его участием в фоторецептрах, расположенных в ретине – сетчатке глаза. При недостатке витамин А в организме ухудшается зрение в сумерках («куриная слепота»). Витамин А человек может получать с пищей в виде предшественников, известных под названием каротиноиды. Β-Каротин содержится в моркови.
Уп р а ж н е н и я
1.Покажите правило Ружички на примере следующих терпенов: мирцена, лимонена, α-терпинена, оцимена.
2.Напишите реакции лимонена со следующими реагентами: избыток НСl,
избыток воды в присутствии кислоты, избыток бромной воды, избыток KMnO4 в водной среде, избыток водорода. Укажите тип реакций, назовите их продукты.
111
3.Напишите реакцию α-пинена с водой в присутствии кислоты, опишите механизм реакции, назовите еѐ продукт.
4.Напишите реакцию ментола с изовалериановой кислотой, укажите тип реакции, назовите еѐ продукт. В состав какого лекарственного препарата входит это вещество?
5.Напишите реакции 3-карена с водой в присутствии кислоты и с водородом. Укажите тип реакций, назовите их продукты.
6.Напишите реакцию камфена с соляной кислотой, опишите механизм реакции, назовите еѐ продукт.
7.Напишите реакции камфоры со следующими реагентами: Br2, H2N-NH- C6H5, H2, H2N-OH. Укажите тип реакций, назовите их продукты. Какое фармакологическое действие оказывает камфора и еѐ производные?
8.Напишите реакцию терпингидрата с избытком уксусной кислоты. Укажите тип реакции, назовите еѐ продукт.
9.Из приведенных ниже веществ выберите те, которые реагируют с ментолом, напишите эти реакции, укажите их тип, назовите их продукты: диэтило-
вый эфир, Cl2(hν), KOH, Na, H-COOH, толуол, HBr.
10.Напишите реакцию превращения β-каротина в ретинол.
11.Из приведенных ниже веществ выберите те, которые реагируют с ретинолом, напишите эти реакции, укажите их тип, назовите их продукты: этанол,
Ca(OH)2, K, CH3COOH, Ag2O(NH3), этиламин, CuO.
12.Напишите реакцию ретинола с пальмитиновой кислотой, укажите тип
этой |
реакции, назовите еѐ продукт. Где он применяется? |
13.Из приведенных ниже веществ выберите те, которые реагируют с рети- |
|
налем, |
напишите эти реакции, укажите их тип, назовите их продукты: |
СН3СН2СООН, Li, HCN, Ag2O(NH3), дибутиловый эфир, гидразин, пиррол, NaHSO3, стирол, аланин.
14.Напишите реакции ретиноевой кислоты со следующими реагентами: пропанол-2, КОН, Rb, пирролидин, аммиак. Укажите тип этих реакций, назовите их продукты.
15.Напишите реакции α-токоферола со следующими реагентами: NaOH, К, уксусный ангидрид. Укажите типы этих реакций, назовите их продукты.
16.Напишите реакции эстрадиола со следующими реагентами: КОН, хлорангидрид пропионовой кислоты(избыток), натрий. Укажите типы этих реакций, назовите их продукты.
17.Напишите реакции тестостерона со следующими реагентами: калий, пропионовая кислота, HCN, изопропиламин, HBr, H2N-OH, Br2(H+). Укажите типы этих реакций и назовите их продукты.
18.Напишите реакции эстрона со следующими реагентами: NaOH, ацетилхлорид, тиламин, H2N-NH2, NaHSO3. Укажите типы этих реакций, назовите их продукты.
19.Напишите реакции андростерона со следующими реагентами: натрий, бутиламин, муравьиная кислота, HCN, мочевина. Укажите типы этих реакций, назовите их продукты.

112
20.Напишите реакции эстриола со следующими реагентами: LiOH, 2 моля уксусной кислоты, избыток рубидия. Укажите типы этих реакций, назовите их продукты.
21.Напишите реакции холестерина со следующими реагентами: уксусная кислота, К, HCl, Cl2(H+). Укажите типы этих реакций, назовите их продукты.
22.Напишите реакцию эргокальциферола(витамина D2) с металлическим калием.
23.Напишите реакцию холекальциферола(витамина D3) с уксусной кисло-
той.
Алкалоиды
Алкалоидами называют гетероциклические азотсодержащие основания растительного происхождения, обладающие выраженным физиологическим действием. Их применение с глубокой древности связано с лечением различных заболеваний. Сильное физиологическое действие многих алкалоидов и наркотические свойства некоторых из них определяют их важнейшее значение и для современной медицины. Природные алкалоиды служат также моделями для создания новых лекарственных препаратов, часто более эффективных и, в то же время, более простых по структуре. В настоящее время известно более 5000 алкалоидов. В основе структуры алкалоидов лежит какой-либо гетероцикл. Это обстоятельство учитывается при химической классификации алкалоидов.
Производные пиридина, пиперидина и пирролидина.
Гигрин – один из наиболее простых алкалоидов, выделенных из Erythroxylon coca (Южная Америка). Гигрин оказывает общее стимулирующее действие. Никотин – весьма токсичный алкалоид, содержание котрого в листьях табака доходит до 8 %. Воздействует на вегетативную нервную систему; сужает кровеносные сосуды. Один из продуктов окисления никотина в жестких условиях – никотиновая кислота.
|
O |
|
[O] |
COOH |
|
|
|
|
|
N |
CH2-C-CH3 |
|
N |
|
|
|
N |
CH3 |
N |
CH3 |
|
|
||
|
|
|
||
|
|
|
|
|
гигрин |
никотин |
|
никотиновая кислота |
|
Кониин и анабазин чрезвычайно токсичные алкалоиды. Кониин парализует окончания двигательных и чувствительных нервов, участвующих в иннервации кожи.
113
|
|
|
|
|
|
|
|
N |
||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
N |
CH2CH2CH3 |
|
|
|
|
|
|
|||
|
|
|
|
N |
|
|
||||
|
|
|
|
H |
||||||
Н |
||||||||||
|
|
|
|
|
|
|
||||
кониин |
|
анабазин |
|
|
||||||
Лобелин и родственные по структуре алкалоиды используются в медицине в виде гидрохлоридов в качестве эффективных средств, стимулирующих дыхание.
|
|
OH |
|
O |
|||
|
|
|
|
|
|
|
|
С H -CH-CH |
N |
CH2-C-C6H5 |
|||||
6 |
5 |
2 |
|
|
|
|
|
CH3
лобелин
Производные тропана
Тропан представляет собой конденсированное бициклическое соединение, в состав которого входят пирролидиновое и пиперидиновое кольца.
Атропин содержится в растениях семейства пасленовых – белладонне, дурмане, белене. Несмотря на высокую токсичность, применяется в глазной практике, благодаря способности расширять зрачок. Кокаин – основной алкалоид Erythroxylon coca. Известен как одно из первых используемых в медицине местноанестезирующих и наркотических средств. Синтетические аналоги кокаина, лишенные наркотических средств, относятся к производным п-аминобензойной кислоты (анестезин, новокаин).
|
|
|
|
O |
|
|
|
|
O |
|||||
|
|
|
|
|
|
|
C6H5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O-C-C6H5 |
|||||
|
|
O-C-CH |
|
|
||||||||||
H |
|
|
|
|
|
CH2OH |
H |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
COOCH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
N |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
CH3 |
|
|
CH3 |
|||||||||
|
|
атропин |
|
|
кокаин |
|||||||||
Пуриновые алкалоиды
К алкалоидам пуринового ряда относятся кофеин, теофиллин и теобромин. Их природными источниками служат листья чая, зерна кофе, бобы какао. Кофеин – эффективное средство, возбуждающее центральную нервную систему и
114
стимулирующее работу сердца. Общестимулирующее действие телфиллина и теобромина выражено меньше, однако, они обладают довольно сильными мочегонными свойствами, т.е. являются диуретиками.
|
|
O |
CH3 |
|
O |
H |
|
O |
CH3 |
|
|
|
|
|
|||||
CH3 |
N |
|
N |
CH3 |
N |
N |
H |
|
N |
|
|
|
N |
||||||
|
|
|
|
|
|
|
|
||
O |
|
N |
N |
O N |
N |
|
N |
N |
|
|
|
O |
|||||||
|
|
|
|
|
|||||
|
|
CH3 |
|
|
CH3 |
|
|
CH3 |
|
|
|
|
|
|
|
|
|
||
|
|
кофеин |
|
|
теофиллин |
|
|
теобромин |
|
Производные индола и имидазола Резерпин, содержащийся в корнях растения раувольфии змеиной (Индия),
широко применяется в медицине, оказывает выраженное гипотензивное действие. Стрихнин – весьма ядовитое вещество, извлекаемое из семян тропического растения чилибухи, в малых дозах действует возбуждающе и находит применение в качестве тонизирующего средства. Пилокарпин, содержащий ядро имидазола, широко используется при лечении глазных заболеваний.
N |
N |
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
C H |
|
CH2 |
|
CH |
|
|
|
2 5 |
|
|
N |
3 |
|
|
|
OCH3 |
|
N |
|
|
|
|
|
O |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
CH3O-C |
O-C |
OCH3 |
O |
O |
O |
|
N |
|
O |
OCH3 |
|
O |
|
|
|
|
|
OCH3 |
|
стрихнин |
|
пилокарпин |
|
|
||
|
|
|
|
|
|
|
|
резерпин
Производные хинолина и изохинолина
К алкалоидам хинолинового ряда относится хинин, содержащийся в коре хинного дерева. Хинин является одним из лучших противомалярийных средств.
Ядра хинолина и изохинолина содержатсяв алкалоидах опия. Основной из них – морфин – обладает сильным обезболивающим свойством, однако при длительном употреблении вызывает наркоманию. Диацетильное производное морфина – героин – наиболее широко применяемый за рубежом наркотик.
Примером алкалоида изохинолинового ряда, также выделенного из опия, служит папаверин, применяющийся в качестве противосудорожного средства.
|
|
|
115 |
|
|
|
|
|
CH2 |
CH=CH2 |
N CH3 |
|
N CH3 |
|
|
|
|
|
|
||||
|
CH2 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
CH3O |
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
|
|
|
N |
|
HO |
O |
OH |
CH3-C-O |
O |
O-C-CH3 |
|
|
|
|
|
|||
хинин |
|
|
|
|
|
O |
|
|
|
морфин |
|
O |
героин |
||
|
CH3O |
|
|
|
|
|
|
|
CH3O |
|
|
OCH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
OCH3 |
|
|
папаверин
Антибиотики
Антибиотиками называют вещества, синтезируемые микроорганизмами и способные препятствовать развитию других микроорганизмов.
По химической структуре антибиотики относятся к различным классам органических соединений. Большая их часть имеет сложную гетероциклическую структуру.
Синтез антибиотиков труден, поэтому в промышленных масштабах их получают микробиологическим путем. Широко развито также производство полусинтетических антибиотиков. Оно основано на химической модификации соединения, выделяемого из культуральной жидкости, вырабатываемой определенным штаммом микроорганизмов.
Пенициллины
В основе структуры пенициллинов лежит пенициллановая кислота, содержащая два конденсированных гетероциклических кольца – пятичленное тиазолидиновое (А) и четырехчленное – β-лактамное (В).
O
|
|
|
|
S |
|
R-C-NH |
S |
|||||
|
|
|
|
|
|
CH |
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
||
|
B |
|
A |
3 |
|
B |
|
A |
|
|||
|
|
N |
|
|
CH3 |
|
|
N |
|
CH3 |
||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
||||||||
O |
|
|
|
O |
|
|
||||||
|
|
|
|
|
COOH |
|
|
|
|
|
COOH |
|
пенициллановая кислота |
общая структура пенициллинов |
|||||||||||
|
|
|
|
|
|
|
как ацильных производных |
|||||
6-аминопенициллановой кислоты
116
Природные и полусинтетические пенициллины представляют собой N- ацилированные различными ацильными радикалами производные 6- аминопенициллановой кислоты. Природа радикала в ацильной группе учитывается в названии пенициллина. Например, соединение с R= C6H5CH2 называют бензилпенициллином, а с R= C6H5OCH2 – феноксиметилпенициллином.
Природные пенициллины обладают довольно избирательным, полусинтетические – гораздо более широким спектром антимикробного действия.
Цефалоспорины
Цефалоспориновые антибиотики близки по строению к пенициллинам, а также содержат β-лактамное кольцо. В основе их структуры лежит цефалоспорановая кислота, содержащая два конденсированных гетероциклических кольца – шестичленное частично гидрированное 1,3-тиазиновое (А) и четырехчленное – β-лактамное (В).
O
|
|
|
S |
|
|
|
R-C-NH |
|
S |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
A |
|
|
|
|
|
B |
|
A |
|
|
O |
|
|
B |
|
O |
|
|
|
|
||||||||
|
|
|
N |
|
|
||||||||||
|
|
|
|
|
|
|
|||||||||
|
|
N |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
CH2OCCH3 |
||||
O |
CH2OCCH3 |
O |
|
|
|
||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
COOH |
|
|
|
|
|
|
COOH |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
цефалоспорановая кислота |
общая структура цефалоспоринов |
||||||||||||||
Антибиотики цефалоспориновой группы являются производными 7- аминоцефалоспорановой кислоты. Они обладают широким спектром действия и тормозят рост некоторых штаммов бактерий, устойчивых к пенициллину.
Антибиотики по химической структуре могут принадлежать не только к гетероциклическим, но и другим классам органических соединений. Например, стрептомицин относится к аминогликозидам, грамицидин и инсулин – к пептидам, а левомицетин – к производным аминодиола. Этот антибиотик имеет относительно простое строение и является пока единственным, производимым полностью синтетическим путем.
|
|
|
|
|
|
|
|
H |
|
H |
|
|
|||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O2N |
|
|
|
|
|
|
|
C |
|
C |
|
CH2OH |
|||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH NH-CO-CHCl2
левомицетин Левомицетин относится к редко встречающимся в природе соединениям,
содержащим в своей молекуле нитрогруппу и атом галогена. Этот антибиотик эффективен в отношении многих грамположительных и грамотрицательных бактерий. Его применяют для лечения брюшного тифа, дизентерии, коклюша, пневмонии и других заболеваний.
117
Тетрациклины
Эти антибиотики представляют собой производные частично гидрированного нафтацена – соединения, состоящего из четырех линейно конденсированных шестичленных карбоциклов. Тетрациклины обладают широким спектром антимикробного действия и могут быть использованы даже при вирусных заболеваниях.
Сl |
N(CH3)2 |
HO |
CH3 |
OH
OH |
CONH2 |
OH O OH |
O |
нафтацен (тетрацен) |
биомицин |
|
Примером тетрациклинового антибиотика служит биомицин – эффективный препарат при заболеваниях, вызванных микроорганизмами, устойчивыми к пенициллину и стрептомицину.
Окисление и восстановление органических соединений в процессах жизнедеятельности.
Окислительно-восстановительные реакции занимают большое место в органической химии. Важнейшее значение они имеют и для процессов жизнедеятельности. С их помощью организм удовлетворяет свои энергетические потребности, поскольку при окислении органических веществ происходит высвобождение энергии.
Окисление в органической химии – процесс удаления водорода с образованием кратной связи или новой связи между атомом углерода и гетероатомом, более электроотрицательным, чем водород (кислородом, азотом, серой и т.д.).
Процесс окисления включает переход от органического субстрата к реагенту – окислителю.
Восстановление – процесс, обратный окислению, сопровождается образованием новых связей с водородом и включает перенос электронов к органическому субстрату.
Окисление
Окислители представляют собой соединения, обладающие высоким сродством к электрону – кислород, пероксиды, азотная кислота, галогены, гипогалогениты, хлорная кислота, оксид марганца, перманганат калия, хромовая кислота.
Окисление органического субстрата протекает тем легче, чем сильнее его тенденция к отдаче электронов. По способности к окислению органические субстраты можно расположить в следующие ряды.
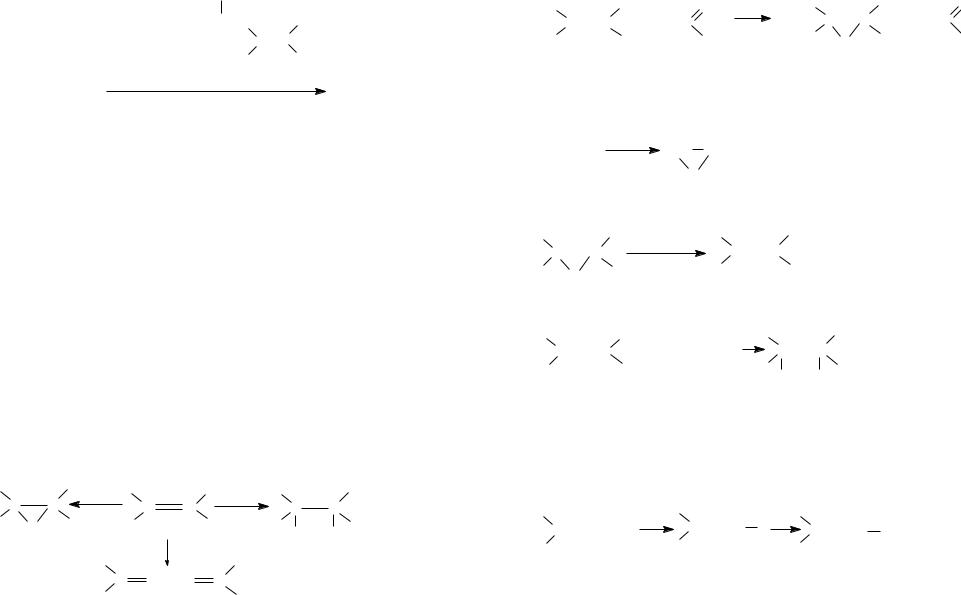
118
I |
|
|
|
R-H < R-OH |
< |
R-NH2 |
|||||||||||||
|
|
|
|
CH3 |
|
|
|
|
CH2 |
< |
|
|
|
|
|
|
|||
II |
|
|
|
< |
|
|
|
|
|
CH |
|||||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
III |
|
|
|
С |
|
|
С |
|
< |
|
С |
|
С |
||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
C (sp2) |
||||||||||
|
|
|
|
C (sp3) |
|
|
|||||||||||||
увеличение способности к окислению
Окисление СН-связей
При сгорании углеводородов происходит их полное окисление с образованием диоксида углерода и воды. При неполном окислении получается набор разных соединений.
Насыщенные углеводороды – наиболее трудно окисляющиеся органические соединения. Для их окисления необходимы жесткие условия (например, горячая хромовая смесь).
Промежуточные продукты окисления – первичные, вторичные спирты и альдегиды – окисляются легче исходных углеводородов. Последующему окислению, как правило, подвергается уже начавший окисляться атом углерода. Конечные продукты неполного окисления углеводородов – карбоновые кислоты, кетоны и третичные спирты – требуют для своего окисления гораздо более жестких условий, необходимых для разрыва углерод-углеродных связей.
Гидропероксиды R-O-O-H – важные промежуточные продукты окисления С-Н связей в мягких условиях, в частности, в условиях организма.
R-H + O2  R-O-O-H
R-O-O-H
Способность С-Н связи к окислению увеличивается, если она расположена рядом с двойной связью или ароматическим кольцом.
Окисление двойных углерод-углеродных связей
В зависимости от условий окисление С=С связей может приводить к эпоксидам, 1,2-диолам (гликолям) или карбонильным соединениям – продуктам расщепления двойной связи.
С С |
С |
С |
С |
С |
О |
|
алкен |
OH |
OH |
|
|
|||
эпоксид |
|
|
||
|
|
1,2-диол |
||
|
|
|
||
С |
O + O |
С |
|
|
карбонильные соединения |
|
|||
119
Эпоксиды – первичные продукты окисления С=С связей в мягких условиях
– образуются при обработке алкенов пероксидными соединениями, например, пербензойной кислотой.
R1 |
R3 |
O |
R1 |
|
|
|
R3 |
O |
||
С |
|
С |
+ C H C |
|
С |
|
С |
|
+ C6H5C |
|
|
|
|
|
|||||||
|
|
|
6 |
5 |
|
|
|
|
R4 |
OH |
R2 |
R4 |
O-OH |
R2 |
|
О |
|||||
алкен |
пербензойная |
|
эпоксид |
|
бензойная |
|||||
|
|
|
|
кислота |
|
|
кислота |
|||
|
|
|
|
|
|
|
|
|
||
В промышленности эпоксиды, в частности, этиленоксид, получают при взаимодействии с кислородом воздуха в присутствии серебряного катализатора при нагревании.
СH2=CH2 O2, kat CH2 CH2
О
1,2-Диолы (гликоли) могут быть получить в результате кислотного или щелочного гидролиза эпоксидов.
|
|
|
H O (H+ или HO-) |
|
|
|
|
|
С |
|
С |
2 |
С |
|
С |
||
|
|
|
||||||
|
|
|
||||||
|
О |
|
|
|
|
|
||
|
|
OH |
OH |
|||||
эпоксид |
|
|
1,2-диол |
|||||
Непосредственно из алкенов 1,2-диолы образуются под действием водного раствора перманганата калия на холоду (реакция Вагнера).
3 С |
|
С + 2KMnO4 + 4H2O |
С |
|
С + 2MnO2 + 2KOH |
|
|
||||
|
алкен
OH OH 1,2-диол
При этом фиолетовая окраска раствора перманганата калия превращается в буро-коричневую окраску оксида марганца (IV). Данная реакция может быть использована как качественная для обнаружения алкенов, а также отличия их от спиртов, поскольку спирты в таких условиях не окисляются.
Карбонильные соединения образуются при окислении алкенов, а также 1,2- диолов в более жестких условиях, необходимых для расщепления углеродуглеродной связи.
|
|
|
|
|
[O] |
С |
|
СH |
[O] |
|
||||
С |
|
|
СH |
|
|
|
С |
|
O + |
COOH |
||||
|
|
|
|
|
|
|||||||||
|
алкен |
|
|
|
|
|
|
кетон |
карбоновая |
|||||
|
|
OH |
OH |
|||||||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислота |
Ненасыщенный атом углерода, связанный с двумя органическими радикалами, превращается при этом в карбонильную группу кетона, в то время как =СН-группа окисляется в карбоксильную, что может быть использовано для установления строения исходного алкена.
