
4 курс / Лучевая диагностика / ЛД венозного ишем. инсульта
.pdf
Ультразвуковые методы диагностики венозных нарушений мозгового кровообращения
Значение ВАШ при ВИ в среднем было равно 7,3±1,6 против 0,6±1,9 при АИ. Чем выше значение по шкале ВАШ при поступлении и ниже значение ПАВС мозгового кровотока, тем более вероятно, что у пациента будет диагностирован инсульт, связанный с ЦВСТ. Оба фактора оказали значимое влияние на оценку прогностической вероятности наличия данного вида инсульта. Диагностическая надежность ПАВС брахиоцефальных сосудов в дифференциальной диагностике артериального и венозного инсульта была также оценена на основании корреляции с показателями КТ-перфузии, использованной в качестве референсного метода.
Отмечены серьезные корреляции ПАВС с параметрами КТперфузии:
1)с МТТ в перифокальной зоне поражения головного мозга (r = –0,42), где отмечена умеренная гиперперфузия (`30%)
при венозном инсульте;
2)с CBV в центральной зоне поражения (r = –0,62) и перифокальной зоне (r = –0,52);
3) с CBF в центральной зоне поражения (r = –0,42).
На наш взгляд [Жучкова Е. А., Семенов С. Е., 2017], использование несложных, безопасных и малозатратных методов разработанной модели («ПАВС+ВАШ головной боли») может способствовать улучшению быстроты и качества ранней диагностики венозного инсульта.
Транскраниальная допплерография (ТКДГ; Transcranial Doppler — TCD) в целом для ишемического инсульта у пациентов, получивших тромболитическую терапию, в сравнении с ангиографией при окклюзии средней мозговой артерии оценивается высоко — чувствительность 91%, специфичность 93% [Burgin W. S. et al., 2000]. ТКДГ используется также для регистрации изменений скоростных показателей кровотока в таких венозных структурах головного мозга, как вена Галена и прямой синус, верхние глазничные вены, базальные вены Розенталя, но без визуализации стенки и определения размеров сосудов [Menegatti E., Zamboni P., 2008]. Наиболее часто исследователи опираются в оценке состояния венозного кровообращения на показатели скорости в прямом синусе [Семенов С. Е., 2003; Шахнович А. Р., Шахнович В. А., 2009]. Отмечено, что венозный отток из полости черепа зависит от положения тела больного (например, скорость кровотока в прямом синусе увеличивается при антиорто-
161

С. Е. Семенов. ЛУЧЕВАЯ ДИАГНОСТИКА ВЕНОЗНОГО ИШЕМИЧЕСКОГО ИНСУЛЬТА
статической нагрузке и уменьшается почти вдвое при ортостати- ческой нагрузке), что объясняется возможным «манжеточным сдавлением» мостиковых вен [Шахнович А. Р., Шахнович В. А., 1996]. Основными гемодинамическими признаками доброкаче- ственной внутричерепной гипертензии при ТКДГ считается повышение максимальной скорости и усиление псевдопульсации кровотока в церебральных венах и синусах [Долгих Г. Б., 2007], венах Розенталя >15 см/с, вене Галена >20 см/с и прямом синусе >30 см/с [Елисеева Н. М. и др., 2001; Чечеткин А. О. и др., 2002; Лелюк В. Г., Лелюк С. Э., 2003]. Большое практическое значение имеет анализ состояния механизмов ауторегуляции мозгового кровотока [Семенютин В. Б., 2004; Белова Л. А., 2010]. Большой интерес представляет индекс церебро-васкулярной реактивности (ИЦВР), так как используемые при этой методике показатели, полученные с помощью однотипных разнонаправленных тестов, являются критериями оценки дисфункции мозгового кровообращения и характеризуют резервно-адаптацион- ные возможности мозгового кровообращения в изменяющихся условиях [Шестаков В. В., 1995; Zeitz O., 2002; Федин А. И. и др., 2009; Шумилина М. В., Горбунова Е. В., 2009].
ТКДГ интракраниальных сосудов мы выполняли векторным датчиком частотой 2 МГц. Вначале из среднего транстемпорального доступа производили стандартное сканирование средних мозговых артерий (СМА) на глубине 60–58 мм на отрезке М1. Определялась пиковая систолическая скорость (υps), пиковая диастолическая скорость (υed), усредненная по времени максимальная (υñð./TAMX). Рассчитывалcя индекс периферического сопро-
тивления — индекс резистентности Пурсилота (ИР) по формуле
ÈÐ = υps – υed,
υps
ãäå ups — пиковая систолическая скорость (см/с); ued — конечно-диастолическая скорость (см/с).
Для парных СМА рассчитывали индекс асимметрии (ИА) по формуле
ÈÀ = υ1ps – υ2ps ,
υ1ps
ãäå u1ps — большая систолическая скорость в одной из СМА; u2ps — меньшая систолическая скорость в СМА.
162

Ультразвуковые методы диагностики венозных нарушений мозгового кровообращения
Индекс церебро-васкулярной реактивности (ИЦВР) СМА определяли с использованием гиперкапнической пробы с задержкой дыхания на 30–40 с, в конце которой регистрировали среднюю скорость (υñð.). Затем проводили гипокапнически-гиперок-
сический тест с форсированным дыханием в течение 30 с и определяли среднюю скорость на пике пробы. Результаты сравнивали со средней скоростью в СМА в состоянии покоя до проведения пробы. Затем рассчитывали ИЦВР по формуле
ÈÖÂÐ (%) = υñð. Ì1 – υñð. Ì2 ,
υñð. Ì
ãäå uñð.Ì — средняя линейная скорость кровотока по СМА в покое (см/с); uñð.Ì1 — средняя линейная скорость кровотока по СМА при задержке дыхания (см/с);
uñð.Ì2 — средняя линейная скорость по СМА (см/с) при гипервентиляции.
Данные тесты были выбраны как наиболее часто применяемые в повседневной практике [Семенютин В. Б., 2004].
Из заднего транстемпорального доступа лоцировались базальные вены Розенталя с двух сторон, из области затылочного «окна» исследовались прямой синус и вена Галена. После обнаружения венозного шума в проекции венозных структур определялась
ups (ñì/ñ).
Частота локации интракраниальных венозных сосудов при ТКДГ в целом составила 76,5%. При исследовании непораженных интракраниальных венозных сосудов в случаях тромботи- ческой окклюзии основных церебральных венозных структур различной локализации имелась общая тенденция к повышению пиковой скорости (òàáë. 6). Средние значения пиковой систолической скорости в прямом синусе при венозном инсульте составили 47,5±11,65 см/с, при кардиоэмболическом инсульте — 23,22±0,66 см/с, при атеротромботическом инсульте — 21,7±0,52 см/с.
Таблица 6
Показатели пиковой систолической скорости кровотока
в венозных сосудах головного мозга при ТКДГ
Исследуемые венозные сосуды |
Диапазон и средние значения пиковой |
|
систолической скорости кровотока |
||
(не окклюзированные) |
||
ïðè ÖÂÑÒ, ñì/ñ |
||
|
||
|
|
|
Базальные вены Розенталя |
11–58 / 30,03±13,57 |
|
|
|
|
Вена Галена |
21–45 / 34,5±7,7 |
|
|
|
|
Прямой синус |
30–66 / 47,5±11,65 |
|
|
|
163

С. Е. Семенов. ЛУЧЕВАЯ ДИАГНОСТИКА ВЕНОЗНОГО ИШЕМИЧЕСКОГО ИНСУЛЬТА
Увеличение отмечалось не только со стороны пиковой систолической скорости кровотока. При венозном инсульте и ЦВСТ достоверно повышаются и такие показатели ТКДГ, как пиковая диастолическая скорость в вене Галена, имеют место отличные от артериального инсульта значения коэффициента асимметрии пиковой диастолической скорости кровотока (ued) в венах Ро-
зенталя (òàáë. 7). Другие показатели не отличаются достоверно от значений при артериальном инсульте. В большом количестве случаев венозного инсульта наблюдалось усиление псевдопульсации.
|
|
|
Таблица 7 |
|
Показатели ТКДГ, которые отличаются при венозном |
||||
и артериальном инсульте |
|
|||
|
|
|
|
|
Показатель |
ÂÈ (n=22) |
ÀÈ (n=102) |
ð |
|
|
|
|
|
|
Коэффициент асимметрии ued |
1,4±0,5 |
0,9±0,3 |
0,00001 |
|
по базальным венам Розенталя |
||||
|
|
|
||
|
|
|
|
|
ued в вене Галена, см/с |
30,8±8,6 |
19,2±6,7 |
0,0002 |
|
Чувствительность метода ТКДГ при исследовании кровотока
âбазальных венах оценивают от 84 до 100% [Лелюк В. Г., Лелюк С. Э., 2003]. Частота локации непораженных базальных вен
âнашем исследовании составила 91,7%. При тромбозе левой базальной вены максимальная скорость кровотока в правой колебалась от 11 до 37 см/с, в среднем 26,6 см/с. При тромбозе правой базальной вены максимальная скорость кровотока в левой была от 21 до 31 см/с, в среднем 24,6 см/с, тогда как в норме в базальных венах Розенталя кровоток имеет максимальную скорость от 11 до 13,7±4,7 см/с [Лелюк В. Г., Лелюк С. Э., 2003]. Следовательно, можно считать, что повышение скорости в противоположной базальной вене является компенсаторным, может служить поводом для подозрения на тромбоз противоположной базальной вены Розенталя. Кроме того, при тромбозе вен Розенталя в 75% случаев отмечено увеличение максимальной скорости кровотока в вене Галена (частота локации 66%) от 24 до 40 см/с (в среднем 28,25 см/с), тогда как в норме она не превышает 20 см/с [Лелюк С. Э., Лелюк В. Г., 2000; Лелюк В. Г., Лелюк С. Э., 2003].
Повышение показателей скорости кровотока по прямому синусу и базальным венам Розенталя, снижение индекса церебро-
164

Ультразвуковые методы диагностики венозных нарушений мозгового кровообращения
васкулярной реактивности (ИЦВР) являются составляющими допплерографического паттерна недостаточности венозного оттока из полости черепа и свидетельствуют о включении путей коллатерального венозного оттока [Шахнович А. Р., Шахнович В. А., 2009]. Полученные нами данные сходны с результатами других исследователей, отмечавших при затруднении венозного оттока увеличение скорости в базальных венах и прямом синусе в 2–3 раза, в сравнении с нормальными показателями [Шахнович А. Р., Шахнович В. А., 1996; Лелюк В. Г., Лелюк С. Э., 2003], что является одним из характерных признаков затруднения венозного оттока из полости черепа и регистрируется в подавляющем большинстве случаев. В литературе оценка направления кровотока по глазным венам также признана важным критерием повышения внутричерепного венозного давления. Ретроградный кровоток может служить свидетельством его повышения [Стулин И. Д., 2001; Никитин Ю. М., 2009; Шумилина М. В., Горбунова Е. В., 2009].
В литературе описываются нарушение тонуса вен, их расширение, легкий венозный застой и повышение внутричерепного давления при дисциркуляторной энцефалопатии [Бурцев Е. М., 1999; Шагал Л. В., Музлаев Г. Г., 2001]. В свою очередь, наличие тромбоза венозных структур отражается в большинстве случаев и на показателях артериальной гемодинамики. Так, было выявлено достоверное снижение скорости кровотока в артериях головного мозга как в систолу, так и в диастолу в зависимости от степени гипертонической энцефалопатии, которая сопровождала инсульт примерно в 2/3 случаев [Тен С. Б., 2006]. При исследовании церебральной гемодинамики у больных с тромбозом поперечных синусов на фоне гипертонической энцефалопатии, начиная уже с I–II стадии, была выявлена очевидная связь недостаточности артериального и венозного звеньев церебрального кровообращения. Наиболее значительные изменения гемодинамических показателей были выявлены в группе пациентов ГЭ II ст. Скорость кровотока в артериях головного мозга как в систолу, так и в диастолу была снижена и статистически значимо различалась (не более 56,22±4,91 см/с) с показателями контрольной группы. Индекс резистентности (ИР) СМА был выше, чем в КГ, — умеренный рост в группе ГЭ I ст., более выраженный в группе ГЭ II ст. (до 0,69±0,09). Также был достоверно выше индекс асимметрии (ИА) скорости кровотока в СМА — от 17–21% в группе ГЭ I ст., до
165

С. Е. Семенов. ЛУЧЕВАЯ ДИАГНОСТИКА ВЕНОЗНОГО ИШЕМИЧЕСКОГО ИНСУЛЬТА
21–27% в группе ГЭ II ст. Наблюдалось снижение ИЦВР, наиболее выраженное в группе ГЭ II ст. (до 0,33±0,07), менее выраженное в группе ГЭ I ст. (до 0,52±0,08). Таким образом, в случаях венозного инсульта при ЦВСТ в целом отмечается повышение индекса периферического сопротивления более 20%, понижение пиковой скорости кровотока от 30% и индекса цереброваскулярной реактивности от 40% и ниже.
Однако при длительно существующем внутричерепном венозном застое и снижении адаптационных способностей у пожилых пациентов (старше 65 лет) могут быть почти нормальные показатели венозной интракраниальной гемодинамики. Так, при ГЭ II ст. повышение пиковой скорости было не столь значительным, чем в отсутствие ГЭ, в базальных венах Розенталя (до 26,73±2,83 см/с) и прямом синусе (до 36,11±2,62 см/с). Объяснением этого факта может быть истощение компенсаторных миогенных механизмов церебральной сосудистой ауторегуляции со снижением сосудистой реактивности вследствие длительных ангиодистонических нарушений. Эти изменения сочетались с недостаточностью мозгового кровотока в артериях головного мозга, поскольку снижение скорости кровотока как в систолу, так и в диастолу практически во всех артериях свидетельствовало о снижении объемного кровотока в головном мозге.

Возможности радионуклидной диагностики венозного инсульта
Радионуклидная диагностика обычно не используется при диагностике острого инсульта, но может дать исследователю дополнительную информацию о распространенности и степени ишемии в случаях, когда результаты стандартной визуализации после КТ- и МРТ-сканирования не коррелируют с клинической картиной или между собой. При наличии в медицинском учреждении соответствующего оборудования сцинтиграфия может быть выполнена уже на 2-е–3-и сутки, т. е. в подострый период заболевания.
Сцинтиграфическая диагностика нарушений венозного кровообращения базируется на совокупной оценке качественных признаков (по уровню накопления РФП) и количественных параметров (по кривым «активность — время» и расчетному показателю CBF). Так, в исследовании с использованием 99mТс было выделено пять типов распределения радиофармпрепарата [Кулакова С. В., Кочкин Ю. Н., 1996]:
υнормальное распределение (яремные вены и синусы без признаков явной асимметрии);
υявная асимметрия (разница накопления 15–30%);
υвыраженная асимметрия распределения технеция (не визуализируется яремная вена с одной стороны, разница накопления более 30%);
υкрупные очаги накопления в верхней луковице внутренней яремной вены и снижение активности на противоположной стороне;
υкрупные интракраниальные очаги патологического накопления технеция (вены и синусы визуализируются слабо).
Снижение накопления радионуклида связывается с сужением просвета сосудов, замедлением кровотока. Наличие «очагов» патологического накопления РФП свидетельствует о компенсатор-
167

С. Е. Семенов. ЛУЧЕВАЯ ДИАГНОСТИКА ВЕНОЗНОГО ИШЕМИЧЕСКОГО ИНСУЛЬТА
ном расширении противоположных синусов [Тимофеева Т. В. и др., 1997].
Нами на ранних этапах изучения ЦВСТ радионуклидная синусосцинтиграфия (РССГ) была выполнена при тромбозе поперечных синусов в подострый период заболевания в 7 случаях на гамма-камере «Оmega 500» («Technicare»). В качестве радиофармпрепарата (РФП) использовали 99mТс-ДТПА (диэтилентриаминопентоацетат). Инъекцию РФП осуществляли в кубитальную вену болюсно в объеме 0,5 мл в дозе 370–555 мБк. Обработку полученной информации начинали с выделения венозной фазы (появление верхнего сагиттального синуса). В процессе качественной оценки сцинтиграмм отмечали наличие или отсутствие асимметрии накопления РФП в парных структурах, дефектов накопления РФП в области синусов и яремных вен. Количественную оценку производили по кривым «активность — время» после выбора зон интереса (поперечные и сигмовидные синусы, яремные вены). Высчитывали степень асимметрии и время достижения максимума накопления РФП в парных венозных структурах. Выявленная асимметрия распределения РФП (ðèñ. 64) за счет снижения накопления в проекции поперечного и сигмовидного синуса на пораженной стороне составила от 37% до 56% [Ефимова И. Ю. и др., 2004]. При асимметрии более 50% визуализация накопления РФП на пораженной стороне практически отсутствует.
Асимметрия в проекции внутренних яремных вен выражена в меньшей степени (до 19–30%) благодаря притоку крови по венам Лаббе и нижним каменистым синусам. При этом на здоровой стороне во всех случаях регистривалась небольшая (1–3 с) задержка пика максимального накопления РФП. В 6 из 7 случа- ев наблюдалось выраженное увеличение накопления РФП в проекции «здорового» сигмовидного синуса и верхней луковицы внутренней яремной вены противоположной стороны.
Опубликованные данные, касающиеся использования радионуклидной диагностики при инсульте, немногочисленны и касаются преимущественно экспериментов на животных [Schaller B. et al., 2003]. В клинике использование радионуклидной диагностики описано уже в хронический период ЦВСТ, например, при формировании дуральных артерио-венозных фистул [Kai Y. et al., 2003]. В единичных исследованиях регионарного мозгового кровотока (рМК) в первые часы развития инсульта указывается, что
168
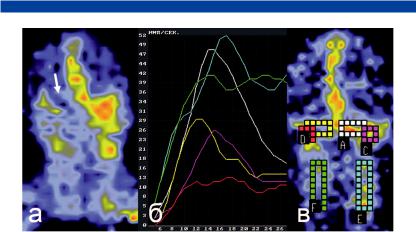
Возможности радионуклидной диагностики венозного инсульта
Ðèñ. 64. Снижение радиоактивности на стороне тромбоза левого поперечного синуса при сцинтиграфии:
a — аналог симптома «дефекта наполнения» в проекции левого поперечного синуса (стрелка) с компенсаторным повышением накопления РФП в проекции противоположного правого поперечного синуса, выраженная асимметрия в проекции внутренних яремных вен; б — кривые «активность — время», маркированные цветом; в — локализация ROI, маркированных цветом для определения накопления РФП в проекции парных венозных структур
ОФЭКТ способна выявить ОНМК уже через 8 ч после начала клинических проявлений инсульта в 90% случаев [De Brune J. F. et al., 1990], а через 48 ч — в 92,2% [Kurokawa H. et al., 1987]. Однофотонная эмиссионная компьютерная томография (ОФЭКТ, Single Photon Emission Computed Tomography — SPECT) и позитронная эмиссионная томография (Positron Emission Tomography — PET) используются для получения информации о концентрации радионуклидов в тканях организма. Пространственное разрешение и качество изображения зависят от общего количества фотонов, записанных детектором. Поскольку из радионуклидов, используемых для SPECT, испускается только один фотон, при получении данных используется коллиматор. Коллиматор имеет более низкую эффективность обнаружения, чем ПЭТ. В ПЭТ дополнительная коллимация не требуется, поскольку пара детектированных фотонов (гамма-лучей) перемещается вдоль параллельных линий. В ПЭТ можно использовать до 500 неколлимированных детекторов, тогда как в SPECT используются только 1 или 3 коллимированных детектора. Хотя разрешение и чувствитель-
169

С. Е. Семенов. ЛУЧЕВАЯ ДИАГНОСТИКА ВЕНОЗНОГО ИШЕМИЧЕСКОГО ИНСУЛЬТА
ность SPECT меньше, чем ПЭТ, доступность радиофармацевти- ческих препаратов для SPECT, использование алгоритмов математической реконструкции для увеличения разрешения делают этот способ радионуклидной диагностики более привлекательным для большинства клинических учреждений. SPECT обеспе- чивает достаточное качество изображения, хорошее соотношение сигнал-шум.
Перфузионные изображения SPECT позволяют билатерально оценить симметричность активности в коре лобной, височной, теменной и затылочной долей, а также в областях базальных ганглиев и таламуса. В качестве референсной зоны для полуколичественного анализа клеточной перфузии указанных областей мозга используется мозжечок. Изменение перфузии может быть представлено очагами гипоили гиперперфузии, а также общим полушарным снижением или усилением аккумуляции РФП. Гипоперфузия указывает на наличие очагов острой ишемии мозговой ткани, а очаги гиперперфузии расцениваются как компенсаторные реакции коллатерального кровообращения. Радиотранслятор накапливается в разных областях мозга пропорционально скорости доставки крови в этот объем ткани головного мозга. Таким образом, измеряется перфузия головного мозга в миллилитрах в минуту на 100 г (rCBF). Изображения SPECT могут быть объединены с МРТ или КТ для анатомической и функциональной корреляции, что облегчает локализацию и определение размеров повреждений.
Нами ОФЭКТ (SPECT), совмещенная с КТ, выполнялась на аппарате GE Discovery NM/CT 670 с использованием радиофармпрепарата Церетек, меченного изотопом 99mTc. Использовались коллиматор LEHR (low energy high resolution), матрица 128^128. Время экспозиции на одну проекцию составляло 30 с. Оценка кровотока осуществлялась по перфузионным картам, построенным на рабочей станции Xeleris 3 в программе Brain SPECT, путем выделения 12 корковых сегментов (по 6 с каждой стороны, что часто применяется в исследованиях перфузии [Jain R. et al., 2004], по два ROI в подкорковых областях с двух сторон и по одному ROI в височных долях большого мозга с двух сторон. Сегментарный анализ клеточной перфузии является полуколичественным, основан на сравнении зон интереса с референсными значениями радиоактивности на уровне полушарий мозжечка с двух сторон. Именно с этой целью критерием исключения из исследования была патология мозжечка в случае ее выявления при
170
