
6 курс / Кардиология / Коронарное_стентирование_и_стенты
.pdfг) способ раскрытия стента (саморасширяющийся или баллонрасширяемый).
Сегодня при изготовлении современных сосудистых стентов в основном используют такие материалы, как медицинская нержавеющая сталь, нитинол, сплавы кобальта с хромом и платины с хромом. Использовавшийся ранее тантал (коронарный стент Wiktor компании Medtronic), несмотря на хорошую биосовместимость, все же был снят с производства из-за мягкости материала и высокой рентгеноконтраст-ности, что делало невозможной оценку просвета артерии внутри стен-та. Следует также отметить, что практически все металлические стенты III и IV поколения делают из сплавов хрома с кобальтом или платиной. Такие сплавы позволяют уменьшить толщину балки стента без ущерба его радиальной силе поддержки (армирования просвета).
В этом ряду отдельно стоят материалы для изготовления биодегра-дируемых каркасов - скаффолдов. Для их конструирования используют поли-L- молочную кислоту (PLLA) и полимолочную-со-гликолевую кислоту (PGLA) (сополимер молочной и гликолевой кислот) и магний. Однако следует отметить, что биодеградируемые скаффолды все еще находятся на предклинических и ранних клинических стадиях испытаний, и на этом пути можно ожидать много важных новостей.
Одной из ключевых характеристик является толщина балки стента. Еще на ранних этапах развития стентирования было доказано, что имеется прямая зависимость между толщиной балок стента и частотой развития in-
stent стеноза, а именно: чем тоньше балка стента, тем реже развивается instent стеноз и соответственно тем реже требуются повторные процедуры реваскуляризации в отдаленном периоде. К примеру, в исследовании ISAR- STEREO-2 сравнивались результаты стентирования стентами Multilink (толщина балок 50 мкм) и Bx-Velocity (толщина балок 140 мкм). Следует отметить, что оба исследуемых стента являются голометаллическими с похожим дизайном (матричный стент с дизайном закрытой ячейки). Разница только в толщине балок стен-тов. Исследование показало, что у пациентов, которым был имплантирован стент Multilink, в отдаленные сроки наблюдения наблюдалась достоверно меньшая частота рестенозов (17,9%), нежели у пациентов, которым был имплантирован стент BX Velocity
(31,4%), p <0,001. Частота повторных реваскуляризаций также была ниже в группе пациентов, которым был имплантирован Multilink, нежели в другой группе (12,3 и 21,9% соответственно, p = 0,002) [30]. Учитывая, что исследуемые стенты отличались в основном по толщине балок, можно с высокой долей вероятности утверждать, что именно толщина балок существенно влияет на прогноз стентирования в отдаленные сроки. Позже
Медицинские книги
@medknigi
этот вывод был подтвержден при аналогичных исследованиях разных стентов с лекарственным покрытием. Эти исследования показали, что чем тоньше балка стента, тем быстрее происходит реэндотелизация стентированного сегмента и тем меньше интенсивность воспалительного ответа и количество осевшего фибрина на поверхность интимы [31]. Исследования с использованием ОКТ у аналогичных групп показали лучшую эндотелизацию лекарственных стентов с меньшей толщиной балки (статистически достоверная разница по количеству балок стентов без эндотелизации). Следовательно, помимо того, что при имплантации стентов с тонкими балками наблюдается меньшее количество таких осложнений, как in-stent стеноз и необходимость повторных процедур реваскуляризации миокарда, можно говорить также о лучшей эндотели-зации стентированных сегментов артерий при этом [32].
На ранних этапах внедрения стентирования в клиническую практику все металлические стенты были разделены на две группы в зависимости от технологии их изготовления: матричные и проволочные. Матричные стенты изготавливали путем вырезания из цельной металлической трубки тонким лазерным лучом, тогда как проволочные стен-ты формировались с помощью закручивания проволоки по заданному дизайну. Наиболее типичными из матричных стентов были стенты Palmaz-Shatz и Multilink, а из проволочных - стенты GianturcoRoubin I, Gianturco-Roubin II и Wiktor.
Впоследствии, по мере совершенствования технологии изготовления стентов, их уже стали делить на группы в зависимости от формы и дизайна ячейки:
1)с закрытой ячейкой;
2)с открытой ячейкой;
3)со смешанным дизайном.
Вместе с определенными преимуществами каждый из этих видов стентов имеет и свои недостатки, которые, как мы уже отмечали, необходимо принимать во внимание при выборе стентов в каждом отдельном случае
(табл. 2).
К примеру, при стентировании массивной, плотной эксцентрической бляшки предпочтительнее использовать стент с закрытой ячейкой, поскольку он обеспечивает лучшую радиальную силу поддержки, следовательно, уменьшается риск пролабирования бляшки через структуру стента. В случаях же, когда предстоит стентирование бифуркации извитого сегмента артерии, считается более целесообразным использовать стент с открытой ячейкой. Однако следует учитывать и то обстоятельство, что имплантация стента с открытой ячейкой в извитой сегмент артерии ведет к заметным
Медицинские книги
@medknigi
деформациям структуры стента. По большому радиусу кривизны балки стента расходятся больше,
чем по малой кривизне, и соответственно концентрация лекарства в разных точках извитого сегмента артерии неравномерна. Поэтому в таких случаях, может быть, имеет смысл провести имплантацию стента с закрытой ячейкой, так как его структура меньше подвержена деформациям и соответственно лекарственное вещество может распределяться более равномерно на поверхности интимы, что, естественно, снизит риск позднего рестеноза.
Таблица 2. Cравнительная характеристика стентов с дизайном
закрытой и открытой ячейки
Параметр |
Закрытая ячейка |
Открытая ячейка |
Радиальная сила поддержки |
+++ |
+ |
Возможность пролапса бляшки |
+ |
+++ |
Соотношение металл/интима* |
+++ |
+ |
Доступ в боковую ветвь |
+ |
+++ |
Приспособление к анатомии артерии** |
+ |
+++ |
Примечание: * - соотношение площади стента к площади внутренней поверхности артерии (интимы); ** - возможность максимальной адаптации структуры стента к извитым сегментам и выраженным анатомическим изгибам артерии.
Подводя итоги обсуждения вопроса о выборе стентов, следует помнить, что на сегодняшний день имеется множество стентов с различными характеристиками, с различным дизайном ячейки, преимуществами и недостатками, поэтому выбор стента должен осуществляться с учетом множества факторов, следует взвешивать все «за» и «против» и только после этого принимать окончательное решение о выборе стента.
На основании накопленного в мире опыта можно сделать вывод, что наиболее оптимальным вариантом металлического стента является стент с возможностью легкой доставки к месту назначения; с низким профилем; с минимальной толщиной балок; с незначительным рекой-лом и большой радиальной силой поддержки.
В отношении механизма раскрытия коронарных стентов следует отметить, что подавляющее большинство из них - баллонрасши-ряемые, в отличие от периферической артериальной системы, где, наоборот, в основном используются саморасширяющиеся стенты. Опыт применения саморасширяющихся стентов при стентировании коронарных артерий показал неприемлемо высокую частоту рестеноза, трудности в проведении и позиционировании. По этой причине они
Медицинские книги
@medknigi
на долгое время были исключены из клинической практики коронарного стентирования. Новый импульс технология коронарных саморасширяющихся стентов получила в эпоху лекарственных стентов. Очевидными преимуществами саморасширяющихся стентов можно считать высокую радиальную силу поддержки, хорошее прилегание стента к интиме и, следовательно, лучшие условия для воздействия антипролиферативного лекарственного покрытия на сосудистую стенку. Перечисленные характеристики дают основание предполагать, что эти типы стентов могут вновь занять важное место в лечении жестких, кальцинированных и эксцентрических поражений, бифуркационных стенозов (для лучшего покрытия устья боковой ветви) и артерий большого калибра (5 мм и более).
Важным, можно сказать, революционным нововведением в технологию производства стентов было создание лекарственных покрытий для них. Стенты с лекарственным покрытием были разработаны и внедрены в клиническую практику с целью уменьшения частоты in-stent стенозов. Стенты с лекарственным покрытием можно классифицировать по следующим признакам:
а) вид лекарственного препарата;
б) какой тип платформы используется для нанесения лекарственного покрытия: постоянная или биодеградируемая полимерная платформа или бесполимерная платформа (лекарство наносится непосредственно на поверхность стента);
в) нанесено ли лекарственное вещество на все поверхности стента или только на сторону, прилегающую к стенке артерии;
г) доза (концентрация) и скорость высвобождения лекарственного препарата.
Известно, что лекарственное покрытие используют для подавления пролиферативной активности клеток и тканей внутри стентов. С целью выбора лекарственных средств, имеющих способность наиболее эффективно подавлять пролиферацию тканей, тестировалось множество препаратов (сиролимус, паклитаксел, дексаметазон, бета-эстрадиол, куркумин, актиномицин D и др.). В дальнейшем спектр лекарственных препаратов, используемых как лекарственное покрытие стентов, значительно расширился. На сегодняшний день самыми распространенными для нанесения на поверхность стента являются препараты лимусового ряда (эверолимус, биолимус А9, зотаролимус, миолимус). Наряду с ними используют также препарат паклитаксел, который хорошо себя зарекомендовал в борьбе с in-stent стенозами. Некоторые из первоначально применяемых лекарственных средств,
Медицинские книги
@medknigi
наоборот, не оправдали надежд, и производители стентов с лекарственным покрытием отказались от их дальнейшего применения (к примеру, дексаметазон, бета-эстрадиол, мембранный белок CD-34, монокло-нальные антитела для ускоренной эндотелизации).
После внедрения лекарственных стентов в клиническую практику было проведено множество исследований по сравнительной оценке эффективности стентов, имеющих покрытие разными лекарственными препаратами.
Одним из первых рандомизированных исследований являлось SIRTAX, в котором сравнивались результаты стентирования стентами, покрытыми сиролимусом (стент Cypher) и паклитакселом (стент Taxus). Исследование показало, что у пациентов, которым имплантировали стенты Cypher, в отдаленном периоде наблюдается достоверно меньше серьезных кардиальных осложнений (MACE), чем у больных, которым имплантировали стенты Taxus (6,2 и 10,8% соответственно, р = 0,009). Преимущество стентов, покрытых сиролимусом, заключалось еще и в том, что при их имплантации частота рестеноза в отдаленные сроки была также статистически достоверно ниже, чем при стентировании стентом Taxus (3,2 и 7,6% соответственно, р = 0,013) [33]. Пациенты, которым имплантировали Cypher, реже подвергались повторным процедурам и операциям реваскуляризации миокарда, нежели те пациенты, которым устанавливали стенты Taxus (4,8 и 8,3% соответственно, р = 0,025). Однако в более позднем проспективном рандомизированном исследовании с участием многих центров REALITY не было выявлено достоверной разницы по частоте in-stent стеноза спустя 8 мес после имплантации сиролимус- и паклитаксел-выделяющих стентов (9,6 и 11,1% соответственно, р = 0,31). По частоте MACE через 12 мес после имплантации исследуемые группы также не отличались достоверно между собой (10,7 и 11,4% соответственно, р = 0,73) [34].
Еще в одном рандомизированном исследовании под названием SPIRIT сравнивались результаты имплантации стентов, выделяющих лекарственные вещества эверолимус (стент Xience) и паклитаксел. Исследование показало, что у пациентов, которым был имплантирован эверолимус-выделяющий стент (Xience V) наблюдалась достоверно меньшая частота кардиальной летальности, острого ИМ и повторных процедур реваскуляризации миокарда, чем у больных, которым был имплантирован стент Taxus: 4,5 и 7,6% (р = 0,02) и 5,1 и 9,0% (р = 0,01) соответственно. В то же время по частоте тромбоза стентов спустя 3 года между изученными группами не было выявлено достоверных различий: 1,2 и 1,8% (р = 0,37) соответственно [35, 36]. К аналогичным выводам
Медицинские книги
@medknigi
пришли S. Bangalore и соавт, выполнившие метаанализ 42 исследований (общее количество пациентов 22 844). По их данным, при имплантации стентов, покрытых эверолимусом, наблюдалась достоверно меньшая частота MACE (летальность, ИМ) и повторных эпизодов реваскуляризации миокарда, чем при имплантации стентов, покрытых паклитакселом и другими препаратами лимусного ряда (зотаролимус, сиролимус) [37].
Несколько иные результаты были получены в большом проспективном исследовании с участием многих центров (всего 1055 пациентов). По данным этого исследования, клинические результаты у больных, которым были имплантированы стенты, покрытые различными препаратами (в том числе зотаролимус, эверолимус, сиролимус и пакли-таксел), через 1 год после их имплантации, достоверно не различались между собой по частоте MACE (р = 0,322), повторных реваскуляриза-ций целевого сосуда (р = 0,190) и тромбоза стентов (р = 0,719) [38].
Однако при более позднем сравнительном метаанализе 51 рандомизированного исследования (всего 52 158 пациентов), проведенном T. Palmerini и соавт., оказалось, что стент из кобальт-хромового сплава, покрытый эверолимусом, ассоциируется с достоверно меньшей частотой кардиальной летальности, ИМ и тромбоза стента спустя в среднем 3,8 года, по сравнению с результатами у пациентов, которым были имплантированы стенты, покрытые паклитакселом, или стенты без лекарственного покрытия (голометаллические стенты).
Следует также особо отметить, что стенты, покрытые препаратами лимусового ряда (эверолимус, сиролимус, биолимус и зотаролимус), по данным многих исследований, в отдаленные сроки имели достоверно более низкие показатели частоты повторной реваскуляризации целевого сосуда по сравнению со стентами, покрытыми паклитакселом [39].
Особый интерес представляет исследование ENDEAVOR III, в котором сравнивались результаты стентирования стентами, покрытыми препаратами одного, а именно лимусового, ряда (зотаролимус и сироло-мус). Исследование показало, что, как и предполагалось, в отдаленные сроки после стентирования названными стентами не было достоверной разницы по частоте MACE, in-stent стеноза, тромбоза стентов и повторных процедур реваскуляризации миокарда между изученными группами больных [40]. Аналогичные результаты были получены в исследовании TWENTE (n = 1309 пациентов), в котором сравнивались результаты стентирования больных стентами зотаролимус и эверолимус [41].
Однако рандомизированное исследование LEADERS, построенное на сравнительном анализе результатов стентирования пациентов
Медицинские книги
@medknigi
стентами первого (Cypher - покрытого сиролимусом) и второго (BIOMATRIX - покрытого биолимусом А9) поколения, показало, что прогноз через 4 года после стентирования был лучше у пациентов, которым был имплантирован BIOMATRIX, у них достоверно улучшается отдаленный прогноз, нежели у пациентов, которым был имплантирован стент Cypher. Это касалось как летальности, перенесенного ИМ, процедур повторной реваскуляризации миокарда (35,1 и 40,4% соответственно, р = 0,024), так и тромбоза стента (2,6 и 4,5% соответственно, р = 0,060) [42, 43, 44]. По полученным из этого исследования результатам можно предположить, что на отдаленные результаты, помимо вида лекарственного препарата, влияют и такие параметры, как дизайн, материал и толщина самого стента. К примеру, толщина стента BIOMATRIX составляет 112 мкм, тогда как стента Cypher - 154 мкм.
Таким образом, проведенные исследования убедительно показали улучшение результатов коронарного стентирования при применении стентов с лекарственным покрытием лимусового ряда.
Следует отметить, что до настоящего времени нет полной ясности, и дискуссия на предмет того, какая платформа стента предпочтительнее для получения лучших отдаленных результатов: на постоянном или биодеградируемом полимере, - продолжается. Патоморфологические исследования показывают, что полимер, постоянно находящийся на поверхности стента, может способствовать развитию хронического воспаления стенки артерии. Вместе с тем он может также являться триггером аллергической реакции, что, в свою очередь, будет способствовать ухудшению отдаленных результатов, повышая риск поздних рестенозов и тромбозов внутри стента. В связи с этим разработчики стентов предложили использовать при конструировании стентов не постоянный полимер, а временный, биодеградируемый, который по прошествии времени будет утилизироваться. При создании такого стента предполагалось, что временное нахождение на стенте полимера с лекарством, с последующей его утилизацией после исчезновения лекарства, должно способствовать улучшению отдаленных результатов. Однако результаты сравнительных рандомизированных исследований не дали однозначного ответа о преимуществе биодеградируемого полимера по отношению к стентам с постоянно присутствующим полимером. Хотя в исследовании LEADERS было показано статистически достоверное снижение частоты позднего (спусия 5 лет) тромбоза при использовании стентов с биорезорбируемым покрытием (Biomatrix) по сравнению со стентами с постоянным полимером (Cypher) [43, 44], в более поздних исследованиях не было обнаружено существенной
разницы в этом аспекте между двумя типами стентов. Исследование показало примерно одинаковую эффективность и безопасность при
Медицинские книги
@medknigi
использовании стентов с постоянным полимерным покрытием и при стентировании биодеградируемыми стентами. Так, в исследовании COMPARE II, где сравнивались результаты коронарной ангиопластики стентами с биодеградируемым полимерным покрытием (тот же Biomatrix) и стентами с перманентным нахождением полимера (Xience V), было показано, что изученные группы больных по частоте MACE (15,6 и 17,3% соответственно, р = 0,26), повторных реваску-ляризаций (10,6 и 9,0% соответственно, р = 0,18), поздних тромбозов стентов (0,9 и 1,5% соответственно, р = 0,17) не различались между собой достоверно [45]. Однако дискуссия на этом не закончилась. Проводились все новые и новые исследования, сравнивавшие результаты стентирования стентами с постоянной и биодеградируемой платформами, содержащими разные лекарственные вещества. В исследовании ISAR-TEST 4 сравнивались результаты имплантации стентов с перманентным полимером, содержащим препарат эверолимус, и с биодегра-дируемым полимерным покрытием, содержащим препарат сиролимус. Исследование не выявило преимущества какого-то из исследуемых стентов. По композитным конечным клиническим критериям (кар-диальная летальность, ИМ в зоне целевого сосуда и реваскуляризация целевого сосуда) группы достоверно не отличалась друг от друга [20,9 и 20,1% соответственно, относительный риск (ОР): 0,95, 95%-й доверительный интервал 0,80-1,13, р = 0,59] [46]. Также не было выявлено достоверного различия между группами по частоте позднего тромбоза стентов (1,7 и 1,2% соответственно, р = 0,59). В другом исследовании SORT OUT VI (n = 2999 пациентов) сравнивались стент с биорастворимым полимером и лекарством биолимус и стент с перманентным полимером и лекарством зотаролимус. Спустя три года после имплантации стентов исследователи не выявили достоверной разницы между группами по таким показателям, как кардиальная летальность (2,7 и 3,4%), ИМ (2,7 и 2,5%) и повторная реваскуляризация целевого поражения (5,4 и 5,5%). По такому важному признаку, как поздний тромбоз стента, группы также не различались (0,4 и 0,7% соответственно, р = 0,33) [47]. A. de Waha и соавт. провели аналогичные исследования у пациентов с сопутствующим сахарным диабетом. 657 пациентам были имплантированы стенты с биодеградируемым полимером, а 437 - с перманентным полимерным покрытием. В результате проведенного исследования оказалось, что отдаленные клинические результаты в изученных группах больных не различались. Через 4 года была отмечена недостоверная разница между группами по частоте MACE - летальности, ИМ в зоне целевого сосуда (р = 0,67) и повторной реваскуляризации целевого сосуда (р = 0,47). Однако в группе пациентов с биодеградируемым полимером наблюдалось достоверное снижение частоты позднего тромбоза стента (р = 0,04), особенно в период от 1 до 4 лет после имплантации стента (р = 0,02) [48].
Медицинские книги
@medknigi
Еще один важный показатель, который необходимо учитывать при выборе оптимального типа стента для имплантации, - доза лекарства, которым покрыт стент, и кинетика его высвобождения. Доза лекарственного вещества, необходимая для нанесения на стенты, определялась экспериментальным путем в зависимости от активности и интенсивности подавления пролиферации тканей. Что же касается кинетики высвобождения лекарства с поверхности стента, то она должна была соответствовать патофизиологическому механизму заживления стенки артерии после процедуры стентирования.
На рис. 16 схематически изображены поэтапные репаративные процессы в стенке артерии после ангиопластики, будь то имплантация стента или баллонная дилатация. Следует отметить, что, по данным патологоанатомических исследований, в течение первой недели после имплантации стента преобладают процессы тромбообразова-ния, тогда как в последующий период развиваются воспалительная реакция и клеточная пролиферация, которые завершаются примерно через месяц с формированием нового просвета, т.е. ремоделированием сосуда в месте проведения стентирования. Следовательно, для регулирования вышеназванного процесса ремоделирования в пользу сохранения максимального эффекта ангиопластики необходимо обеспечить воздействие лекарственных веществ на все этапы ремоделирования. Исходя из того, что на первых этапах преобладает тромбообразование, в течение первых семи дней следует направить усилия на уменьшение риска тромбоза (угнетение агрегации тромбоцитов с помощью двойной антиагрегационной терапии (ДААТ)). В последующем же на первый план выходит борьба против клеточной пролиферации, которая также требует противодействия лекарственным воздействием. Поэтому необходимо, чтобы лекарство высвобождалось, как минимум, в течение одного месяца, т.е. всего полного цикла ремоделирования просвета сосуда. Важно помнить, что быстрое высвобождение лекарства повышает риск избыточной пролиферации тканей и образования раннего in-stent стеноза, и наоборот, слишком медленное высвобождение препарата чревато угнетением процесса эндотелизации поверхности стента и повышением риска позднего тромбоза стента.
Медицинские книги
@medknigi
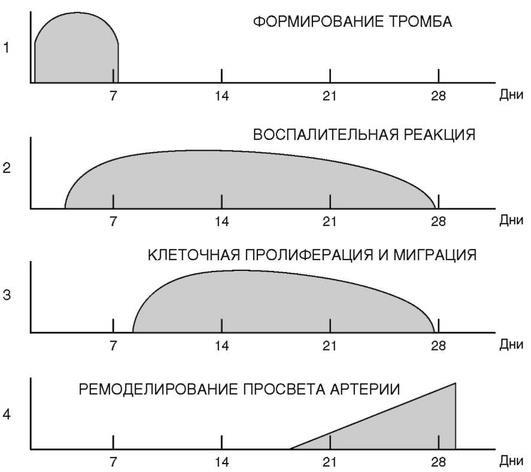
Рис. 16. Схематическое изображение поэтапного процесса заживления в стенке сосуда в зависимости от времени имплантации стента
Известно, что от 60 до 90% объема лекарственного препарата высвобождается в течение первых 30 дней после имплантации, и это считается достаточным для угнетения пролиферативных процессов в стенке артерии. Такими характеристиками обладают стенты, начиная со второго поколения.
Завершая разговор о выборе наиболее оптимальных по своим характеристикам стентов, можно высказать мнение, что, по всей вероятности, «идеальным» среди голометаллических стентов является тот, который легко доставляется, имеет маленький профиль доставляющей системы и стента, минимальную толщину балок (60-80 мкм), незначительную степень «рекойла» (спадения) и высокую радиальную силу поддержки.
Что же касается лекарственных стентов, то из них наиболее оптимальными можно считать те, которые имеют лекарственное покрытие
лимусового ряда и тонкий слой полимерного покрытия (вне зависимости от того, какой полимер используется: биодеградируемый или постоянный). Говоря о материалах, используемых для изготовления каркаса стентов, следует отметить, что используемые сегодня для этих целей современные
Медицинские книги
@medknigi
