
6 курс / Гастроэнтерология / Острый_панкреатит_Савельев_В_С_,_Буянов_В_М_,_Огнев_Ю_В_
.pdfмкмоль/мин•мл и в ряде случаев достигала максимального уровня— 15,84 мкмоль/мин•мл. (В норме активность ТА в крови не определяется.) Транс-амидиназемия в течение всего периода заболевания (1—9-е сутки) наблюдалась у 10,9% обследованных, у остальных отмечалась эпизодически. Результаты определения активности ТА в сыворотке крови больных жировым и геморрагическим панкреонекрозом представлены ниже (см. с. 77). Они статистически не отличаются от результатов, полученных при обследовании больных отечным панкреатитом. Таким образом, приведенные данные свидетельствуют о том, что при клинически легко протекающих формах острого панкреатита, квалифицируемых нами как интерстициальный отек поджелудочной железы, в большинстве случаев выявляются признаки деструкции панкреоцитов. По нашему мнению, отечная форма острого панкреатита есть вторичная воспалительная демаркационная реакция на первичный некробиоз; железистой паренхимы поджелудочной железы и может рассматриваться лишь как начальная фаза прогрессирующего панкреонекроза. Мнение о последовательно-фазовом характере перехода интерстициального отека поджелудочной железы в некроз панкреоцитов не находит подтверждения в наших исследованиях. Таким образом, с клинико-морфологических позиций отечный панкреатит представляет собой абортивную форму панкреонекроза. Причины спонтанной остановки патологического процесса в одном случае и прогрессирования в другом неясны. Для их изучения требуются фундаментальные исследования. Есть основание предполагать, что в процессах формирования первичного аффекта роль основного защитного механизма выполняет плазморрагический отек поджелудочной железы. Выход в интерсти-ций плазменных ингибиторов способствует блокированию активированных протеолитических ферментных систем.
Основные патогенетические механизмы прогрессирования панкреонекроза были изучены нами в эксперименте и клинике. На белых крысах с ЭОП, который воспроизводили перевязкой выводных протоков железы с одновременной стимуляцией ее секреции пилокарпином из расчета 10-4 мг/г массы, методом витальной микроскопии и морфометрии проведено наблюдение
микроциркуляции в поджелудочной железе через l,5—3—6 12 и 24 ч от начала опыта.
Особенностью строения поджелудочной железы у крыс является относительная разобщенность долек, которые несколько уплощены и расположены между листками брыжейки двенадцатиперстной кишки.
В результате стромаль-ные элементы, в частности сосудистые «ножки» долек, доступны биомикроскопии с помощью специально сконструированного световода.
Биомикроскопически общий план строения микроциркуляторного русла поджелудочной железы не отличается от такового других органов [Куприянов В. В. и др., 1975]. Внутрь каждой дольки направляются артериолы конечного типа. Разветвляясь, артериолы распадаются на сеть капилляров, которая окружает ацинарные клетки. Отток крови происходит через посткапиллярные венулы, собирающиеся в центральную венулу, которая затем впадает в кольцевой венулярный анастомоз. Внутренний диаметр артериол составляет в среднем 16,9±1,5 мкм, венул — 23,3±1,2 мкм. Поток эритроцитов в артериолах представляется гомогенным, отдельные клетки неразличимы. По периферии сосудов отчетливо виден пристеночный слой плазмы. В капиллярах с относительно низкой скоростью кровотока видны отдельные эритроциты, которые движутся изолированными скоплениями, разделенные узкими прослойками плазмы.
При изучении изменений микроциркулярного русла поджелудочной железы при ЭОП выявлено, что уже через l,5 ч от начала опыта, когда четко выявляются все признаки первичного аффекта, отмечается заметное усиление тока крови в артериолах и появляется феномен пристеночного стояния лейкоцитов в венулярном отделе (рис. 8).
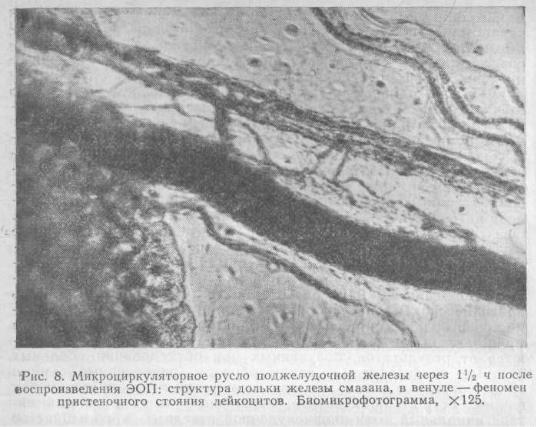
Ткань железы теряет свою прозрачность, структура становится смазанной и четко не выявляется из-за резкого плазматического отека интерстиция, который виден невооруженным глазом (микрофотограмма).
Спустя 3 ч с момента индукции ЭОП в интерстиции появляются единичные кровоизлияния, в просвете лимфатических капилляров видны эритроциты. Просвет артериальных сосудов и отчасти венулярных умеренно суживается и в венулярном отделе микроциркуляторного русла появляются отчетливые признаки внутрисосудистой агрегации эритроцитов: замедление потока клеток, смазанность и неровность его контуров. Движущаяся кровь приобретает характер вязкой, аморфной массы. Через 6 ч состояние циркулирующей крови резко изменяется и развивается sludgeсиндром: поток эритроцитов представляет собой компактные агрегаты из склеившихся клеток, которые придают этому потоку прерывистый вид и медленно, с явным затруднением продвигаются по сосудам. Резко замедляется кровоток, повышается проницаемость и увеличивается диаметр всех сосудов, но особенно сильно эти изменения выражены в посткапиллярном и венулярном звене: множественные очаговые кровоизлияния наблюдаются в окружающей железистой ткани и интерстиции, сосуды эктазированы и заполнены
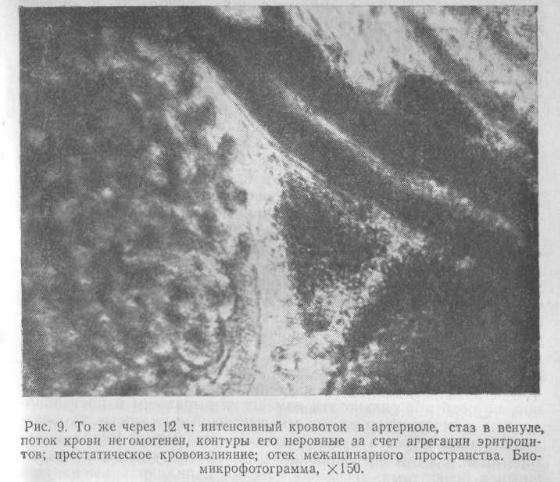
медленно движущимися агрегатами. В лимфатических капиллярах выявляется большое количество эритроцитов.
Через 12 ч в поджелудочной железе наблюдаются грубые и, повидимому, необратимые циркуляторные расстройства. Арте-риолы и венулы долек резко расширены. Диаметр артериол в среднем составляет 25,5±1,8 мкм (Р<0,05), венул — 33,2± ±2,7 мкм (Р<0,05). В
большинстве крупных сосудов, пре- и посткапиллярах — полный стаз. Множественные кровоизлияния местами сливаются в обширные поля, в результате чего биомикроскопия в этих участках поджелудочной железы невозможна. Ряд венул тромбирован. Большая часть капилляров, окружающих ацинарные клетки, выключена из кровотока. Лимфатические капилляры эктазированы, заполнены аморфными массами эритроцитов, резко замедленный кровоток удается увидеть лишь в некоторой части сосудов, причем агрегаты эритроцитов совершенно видоизменяют и деформируют структуру потока крови (рис.9).
Спустя 24 ч от начала опыта поджелудочная железа макроскопически резко отечна, имбибирована кровью, на поверхности видны
множественные очаги жирового некроза. Прижизненная микроскопия поджелудочной железы в этот период практически невозможна. Морфологическая картина в эти сроки соответствует геморрагическому панкреонекрозу.
Таким образом, при остром панкреатите в случае прогрессирующего течения последовательно развиваются гиперергическая микрососудистая реакция, а затем нарушения микроциркуляции, которые уже через 12 ч от начала опыта становятся необратимыми. Экспериментальные данные оказались сопоставимыми с приведенными ниже результатами исследования ККС, активность которой в лимфе, перитонеальном экссудате и крови у больных острым панкреатитом в те же сроки заболевания (24— 72 ч) повышена.
Одной из основных причин прогрессирующего течения острого панкреатита являются глубокие нарушения микроциркуляции в поджелудочной железе. На этом фоне усиливается некробиоз панкреоцитов, который является одной из ведущих причин локальных патобиохимических расстройств при панкреонекрозе. Второй (тесно взаимосвязанной с первой) причиной являются локальные патобиохимические расстройства, которые усиливают первоначально через ККС органной лимфы микроциркуляторные нарушения и вызывают аутогистолиз. Наконец, третья практически важная причина заключается в усугублении расстройств кровообращения в поджелудочной железе в результате нарушений центральной и периферической гемодинамики, которые возникают под влиянием попадающих в кровь протеолитических ферментов и активированной ими ККС Ранее мы указывали, что воздействие липазы и трипсина имеет
ведущее значение в формировании основных патобиохимических видов панкреонекроза — жирового и геморрагического. Мы проследили некоторые механизмы прогрессирования патобиохимических видов панкреонекроза.
В многочисленных клинических и экспериментальных исследованиях довольно подробно описана патогистологическая картина жирового и геморрагического панкреонекроза. Однако остается много неясностей в представлениях о патоморфогенезе этих двух видов аутолиза поджелудочной железы и не изучены клинические аспекты морфологической трансформации первичного аффекта в жировой или геморрагический панкреонекроз. Мы провели сопоставительный клинико-морфологический анализ результатов патогистоморфологического исследования поджелудочной железы
умерших от острого панкреатита. Были обнаружены все известные патогистоморфологические признаки панкреонекроза: 1) дискомплексация ацинусов и отдельных ацинозных клеток, дистрофия, некробиоз и некроз панкреоцитов; 2) жировые некрозы в междольковой и внутридольковой жировой клетчатке, а также в околожелезистой клетчатке; 3) резко-выраженный отек внутридольковой и междольковой соединительной ткани с белковым пропитыванием; 4) фибриноидный некроз микрососудов, обширные кровоизлияния в междольковую и внутридольковую соединительную ткань, меж- и интраацинозные пространства; 5) распространенные тромбозы микроциркуляторного русла (венул); 6) перифокальная демаркационная воспалительная реакция в виде полнокровия сосудов, белкового отека, лейкоцитарной и клеточной инфильтрации, разрастания соединительной ткани.
Жировой панкреонекроз как нозологическая единица в отличие от геморрагического не получил в литературе достаточна полного освещения. По мнению А. И. Абрикосова (1958), И. В. Давыдовского (1958) и других авторов, некрозы жировой ткани в поджелудочной железе встречаются в 25—27% всех вскрытий и имеют ограниченное клиническое значение. По нашему мнению, этот вид панкреонекроза имеет самостоятельное патогенетическое и клиническое значение. Патогенез жирового панкреонекроза представляет собой одну из важных проблем, требующих дальнейшего изучения.
Жировой панкреонекроз формируется под воздействием патологически активированной, преимущественно липолитической группы панкреатических и тканевых ферментов. В классическом варианте первичный аффект ограничен пределами фасциальных футляров долек. В последующем распространении активированных липаз и формировании жирового панкреонекроза активное участие принимает лимфатическое микроциркуляторное русло поджелудочной железы и окружающей клетчатки. При этом блокада путей лимфооттока очагами жирового некроза способствует значительному увеличению отека поджелудочной железы. Микрососудистая перифокальная реакция характеризуется полнокровием и плазморрагией. Одновременно выражены типичные признаки демаркационного воспаления — лейкоцитарная и клеточная инфильтрация.
Морфологическая картина жирового панкреонекроза достаточно характерна. Поджелудочная железа увеличена в 3—4 раза, бугристая за счет увеличения отдельных долек, плотная и имеет пестрый вид изза множественных белесовато-желтых или желтовато-серых,
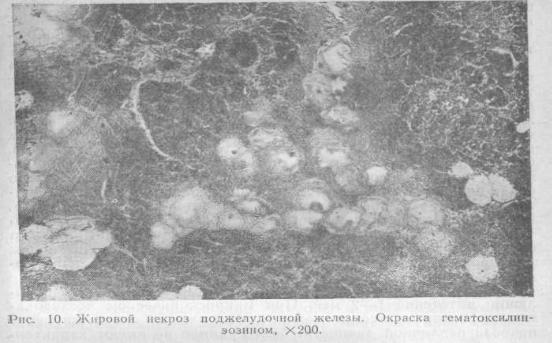
окруженных красноватым венчиком очажков жирового панкреонекроза, которые иногда сливаются в отдельные полигональные поля. На разрезе в толще железы очаги жирового некроза образуют распространенные междольковые и внутридольковые скопления, принимающие в ряде случаев вид казеозных масс. Отдельные очажки и скопления некротизированных клеток окружены красноватым пояском перифокального демаркационного воспаления. Кровоизлияния нетипичны для этого вида панкреонекроза, но могут наблюдаться, принимая иногда распространенный характер. При этом образуется вариант жирового панкреонекроза с кровоизлияниями, или так называемый смешанный жировой панкреонекроз.
В очагах жирового некроза поджелудочной железы все клеточные элементы находятся в состоянии дистрофии, некробиоза или некроза и не дифференцируются. Ядра в липоцитах и панкреоцитах почти неразличимы или отсутствуют. Внутриклеточно среди детрита обнаруживаются глыбки кальциевых мыл и кристаллы жирных кислот. Зона некроза в зависимости от длительности заболевания окружена в различной степени выраженным лерифокальным воспалением с полнокровием сосудов, экстравазатами, белковым пропитыванием стромы, лимфоидной, эози-нофильной, гистиоцитарной гигантоклеточной или круглокле-точной инфильтрацией, разрастанием мезенхимальных элементов (рис. 10).
Отличительными особенностями жирового панкреонекроза являются:
диссеминация очажков жирового некроза по париетальной и висцеральной брюшине, круглой и серповидной связкам печени, плевре, перикарду, предбрюшинной и подкожной жировой клетчатке, а также вовлечение перипанкреатической клетчатки и сообщающихся с ней паракольных клетчаточных пространств, брыжеек, связок, малого и большого сальников. Собственно забрюшинная клетчатка, заключенная в фасциальные футляры «средостения живота», и околопочечная клетчатка редко вовлекаются в процесс, что обусловлено указанными анатомическими особенностями и характером лимфооттока. В брюшной полости появляется мутный, зеленоватый или желтоватый серозный выпот, а в эпигастральной области иногда образуется плотный опухолевидный инфильтрат значительных размеров, в состав которого входят желудок и поперечная ободочная кишка.
Жировой панкреонекроз чаще подвергается медленной инволюции в течение 1—2 мес. При микроскопическом исследовании инфильтрата всегда можно обнаружить очаги жирового-некроза различной давности: более ранние не имеют характерной лейкоцитарной и клеточной перифокальной инфильтрации, более поздние находятся в стадии рубцевания, инкапсуляции глыбок жирнокислого кальция и кистозных образований, содержащих детрит. Рассасывание описанных выше очагов жирового-некроза происходит в результате процессов организации, рубцевания и кальциноза. Репаративные процессы заканчиваются соединительнотканным замещением ацинарного аппарата, метаплазией эпителия и рубцовой обструкцией выводных протоков поджелудочной железы, в результате чего возможно развитие ретенционных кист. Реже, при массивных жировых некрозах, в поджелудочной железе и клетчаточных пространствах образуются различной величины кистозные полости, содержащие аморфный клеточный детрит, кальциевые мыла и кристаллы жирных кислот. Присоединение инфекции в этих случаях ведет к образованию множественных абсцессов в поджелудочной железе, клетчаточных пространствах, брыжейках, большом сальнике. Геморрагический панкреонекроз формируется под влиянием патологически активированных, преимущественно протеолитических ферментов поджелудочной железы. В классическом варианте первичный аффект, как это было подробно описано выше, только первоначально очаговый. Вскоре (через 6—12 ч) процесс принимает диффузно-очаговый характер. В прогрессировании геморрагического панкреонекроза основную роль играет индуцированная протеазами гиперергическая микрососудистая
реакция, которая носит двухфазный констрикторно-дилатационный характер, сопровождается диссеминированным внутрисосу-дистым свертыванием и деструкцией преимущественно венулярных стенок. В этих случаях лимфатическое органное русло интенсивно выполняет дренажную функцию и при блокаде путей лимфооттока деструктивно измененными эритроцитами резко усугубляются дистрофические расстройства железистой паренхимы. Элементы демаркационного воспаления (лейкоцитарная и клеточная инфильтрация) не выражены. Морфологическая картина при геморрагическом панкреонекрозе хорошо изучена. Поджелудочная железа умеренно увеличена, уплотнена, багрово-черного цвета, на разрезе — темно-красного или бурого цвета с участками неизмененной структуры. Жировые некрозы нехарактерны для классических вариантов геморрагического панкреонекроза с «молниеносным» течением. Практически жировые некрозы встречаются довольно часто, и в ряде случаев наблюдаются варианты геморрагического панкреонекроза с распространенными жировыми некрозами — так называемый смешанный геморрагический панкреонекроз, течение которого отличается образованием перипанкреатического инфильтрата. Патогистологически в поджелудочной железе на фоне очагов дискомплексации ацинусов, дистрофии, некробиоза и некроза панкреоцитов, перемежающихся с участками неизмененной ацинарной ткани, преобладают явления гиперергической реакции микрососудов в виде резко выраженного полнокровия, значительного белкового отека и пропитывания стромы с обширными полями кровоизлияний вокруг венул с деструированной стенкой, содержащих свежие тромбы (рис. 11).
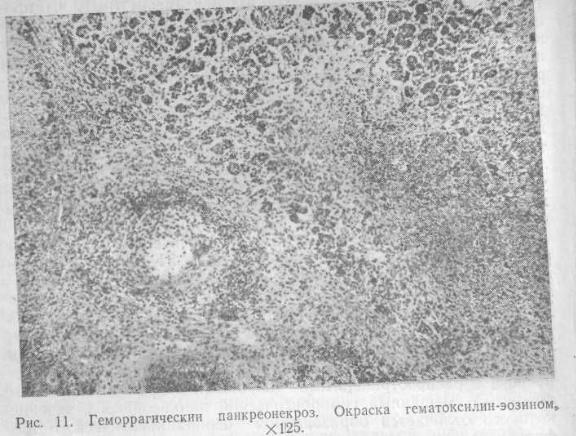
С той или иной частотой встречаются и очаги жирового некроза паренхимы.
Отличительной особенностью геморрагического панкреонекроза является неограниченное распространение геморрагического экссудата с последующим развитием ферментативного асептического перитонита и дегенеративной асептической флегмоны забрюшинной клетчатки.
Панкреатогенный перитонит редко выделяют как осложнение острого панкреатита. Как показали наши лапароскопические исследования, перитонеальный выпот при остром панкреатите встречается гораздо чаще, чем принято считать. Однако наличие панкреатогенного выпота в брюшной полости без признаков воспалительной реакции брюшины, по-видимому, еще нельзя назвать перитонитом. В частности, мы не
склонны |
разделять мнение Г. Н. Акжигитова (1974), который |
считает, что течение отечного панкреатита может осложняться |
|
серозным |
перитонитом. О панкреатогенном перитоните можно |
говорить лишь при наличии выпота с высокой активностью |
|
панкреатических ферментов в сочетании с признаками воспаления брюшины (гиперемия, субсерозные кровоизлияния, очажки жирового некроза). Генез панкреатогенного перитонита сложен, и связан не
