
- •Физические основы
- •Введение
- •1. Термодинамическая система. Основные параметры состояния системы
- •2. Уравнение состояния идеального газа. Идеальная газовая смесь
- •3. Термодинамические процессы
- •4. Внутренняя энергия термодинамической системы
- •5. Энтальпия
- •6. Эквивалентность теплоты и работы. Историческая справка
- •7. Особенности процессов передачи энергии в форме теплоты и работы
- •8. Первый закон термодинамики для замкнутой термодинамической системы
- •9. Первый закон термодинамики в дифференциальном виде. Формула для расчёта механической работы при изменении объёма системы
- •10. Понятие теплоемкости
- •10.1. Общие сведения
- •10.2. Теплоёмкость газов
- •10.3. Теплоёмкость твёрдых и жидких тел
- •Значения температуры Дебая для некоторых веществ
- •11. Открытие энтропии
- •12. Второй закон термодинамики
- •13. Третий закон термодинамики
- •14. Основные соотношения для расчёта процессов в идеальном газе
- •15. Расчёт процессов в идеальном газе
- •15.1. Изохорный процесс
- •15.2. Изобарный процесс
- •15.3. Изотермический процесс
- •15.4. Адиабатный процесс
- •15.5 Политропный процесс
- •Значение показателя политропы n для основных термодинамических процессов в идеальном газе
- •Библиографический список
- •2.1. Уравнение Клапейрона
- •2.2. Понятие моль вещества
- •2.3. Закон Авогадро
- •2.4. Уравнение Клапейрона – Менделеева
- •3.1. Смеси идеальных газов
- •3.2. Парциальные давления в газовой смеси. Закон Дальтона
- •3.3. Приведённый объём компонента газовой смеси. Закон Амага
- •3.4. Химический состав газовой смеси
- •3.5. Газовая постоянная идеальной газовой смеси
- •3.6. Кажущаяся молярная масса идеальной газовой смеси
- •3.7. Удельный объём или плотность газовой смеси
- •3.6. Соотношение между массовыми и объёмными долями идеальной газовой смеси
- •4.1. Обратимые и равновесные процессы
- •5.1. Удельные объёмные и мольные теплоёмкости
- •5.2. Соотношения между удельными теплоёмкостями для газов и газовых смесей
- •5.3. Расчёт значений средних теплоёмкостей
- •5.4. Теплоёмкость смеси идеальных газов
- •6.1. Существование энтропии у реальных (не идеальных) газов
- •6.2. Существование энтропии у систем, находящихся в жидком или твёрдом состояниях
- •Оглавление
- •194021, Санкт-Петербург, Институтский пер., 5.
2.1. Уравнение Клапейрона
В 1834 году французским физиком Клапейроном путём обобщения уже имеющихся экспериментальных данных было получено уравнение состояния идеального газа следующего вида [4]:
p υ = R T, (1)
где р, υ и Т – основные термодинамические параметры состояния – абсолютное давление, удельный объём и абсолютная температура соответственно, Па, м3/кг, К; R – газовая постоянная, имеющая своё постоянное значение для каждого конкретного газа, Дж/(кг∙К).
Величина R по смыслу является коэффициентом пропорциональности в линейной зависимости произведения (p υ) от T. Значение R определяется экспериментальным путём.
Французский учёный Клапейрон с 1820 по приблизительно 1830 год жил и работал в Санкт-Петербурге. Он преподавал в Институте инженеров путей сообщения и руководил кафедрой прикладной механики.
Примечание:
Уравнение состояния идеального газа (уравнение Клапейрона) характеризует связь между параметрами состояния p, υ и Т. Оно выводится на базе следующих экспериментальных данных [4].
В 1802 году экспериментально была установлена зависимость между объёмом газа и его температурой при условии, что давление газа остается постоянным. Эта зависимость называется законом Шарля – Г.Люсака:
![]() ,
при р
= const, (1)
,
при р
= const, (1)
где
р
– абсолютное давление газа, Па; V
– объём, занимаемый газами, м3;
Vo
– объём, который занимает рассматриваемый
газ при температуре 0 оС,
м3;
t
– температура газа, оС;
α – среднее значение температурного
коэффициента объёмного расширения в
интервале температур от 0 до t
оС,
![]() .
.
Экспериментально установлено, что
![]() .
.
Если обе части выражения (1) разделить на массу М, кг. Получим зависимость для удельного объёма υ, м3/кг, этого газа:
![]() ,
при р
= const,
(2)
,
при р
= const,
(2)
где υо – значение удельного объёма газа при 0 оС, м3/кг.
Также из экспериментов известна зависимость между давлением газа и его температурой при условии, что объём газа остаётся постоянным:
![]() ,
при υ
= const,
(3)
,
при υ
= const,
(3)
где
ро
– давление, которое имеет рассматриваемый
газ при температуре 0 оС,
Па; β – среднее значение температурного
коэффициента давления в интервале
температур от 0 до t
оС,
причём β = α,
![]() .
.
График линейной зависимости р(t) (3) представлен на рис. 1.
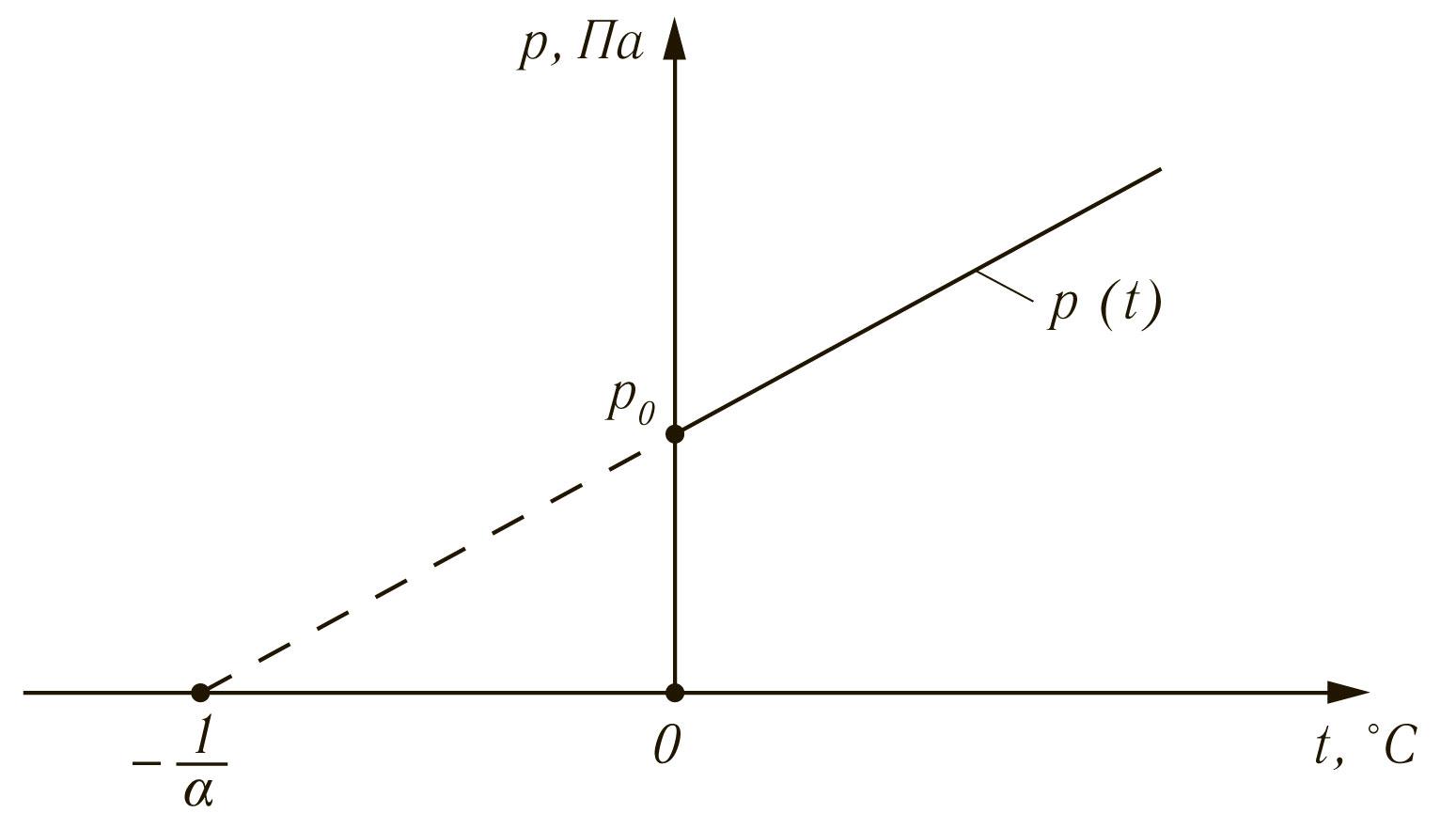
Рис. 1.График линейной зависимости (3)
Продолжить
график на рис. 1 влево далее точки
![]() невозможно, так как абсолютное давление
газа не может иметь отрицательных
значений по своему определению.
невозможно, так как абсолютное давление
газа не может иметь отрицательных
значений по своему определению.
Введём обозначение:
![]() ,
(4)
,
(4)
где
Т
– абсолютная температура, измеряемая
в градусах Кельвина (К), шкала которой
строится на базе температурной шкалы
Цельсия путём переноса начала отсчёта
в точку
![]() =
– 273,15С.
=
– 273,15С.
Таким
образом, нуль отсчёта абсолютной
температуры расположен при температуре
– 273,15 оС,
то есть сдвинут относительно нуля
градусов Цельсия влево на величину
![]() .
.
Нулевая точка отсчёта по шкале абсолютной температуры называется абсолютным нулем.
Абсолютный нуль (Т = 0 К) является самой низкой и «холодной» из всех температур. Экспериментально установлено, что охладить любое тело ниже абсолютного нуля невозможно.
С учётом (4) экспериментальные зависимости (2) и (3) примут вид:
υ = υо ∙ α ∙ Т = a ∙ Т, при р = const, (5)
р = ро ∙ α ∙ Т = b ∙ Т, при υ = const, (6)
где a и b – размерные константы, не зависящие от Т, a = υо ∙ α и b = ро ∙ α.
График линейной зависимости (6) р(Т) приведён на рис. 2.
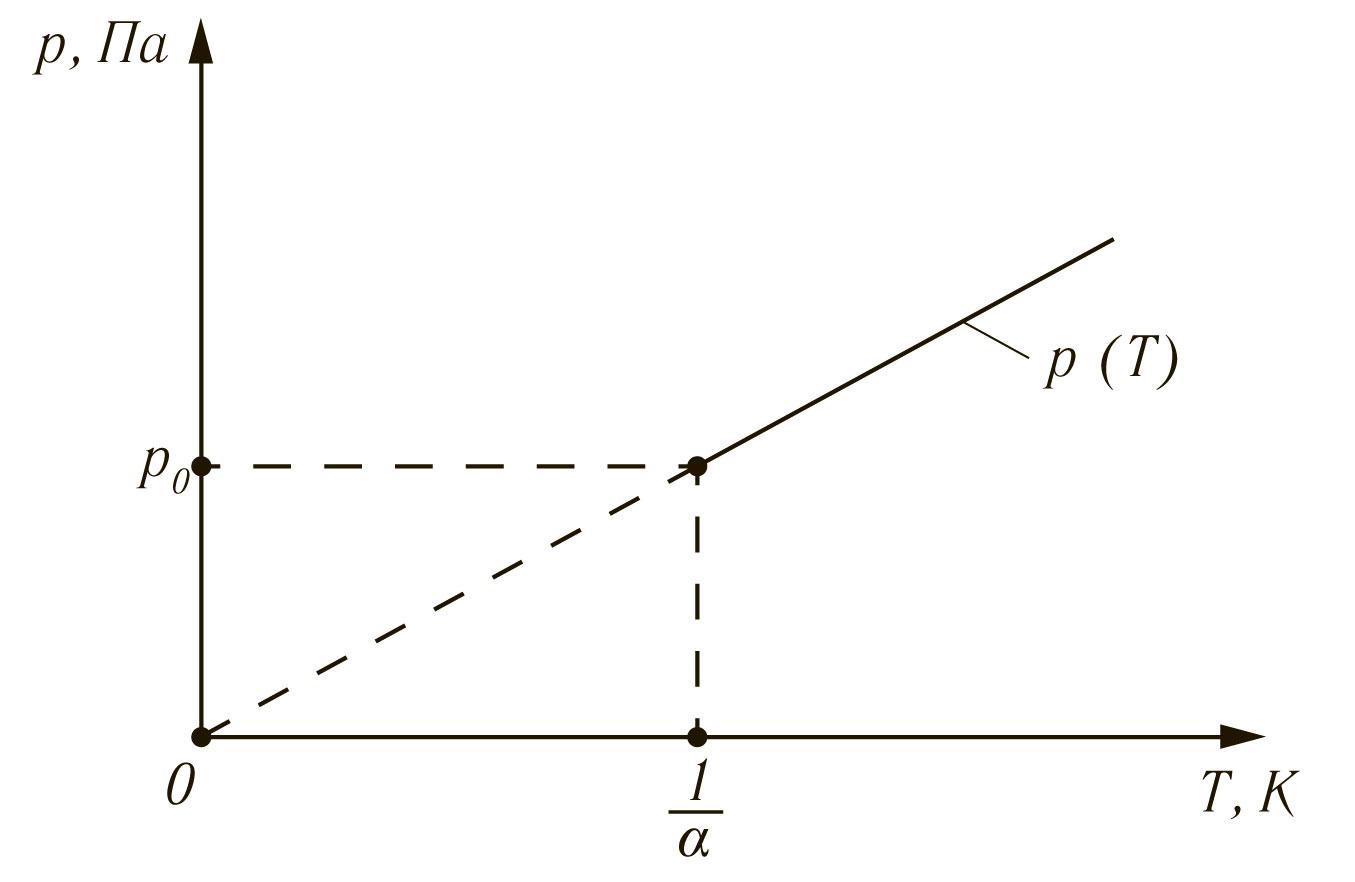
Рис. 2.График линейной зависимости (6)р(Т)
Задолго до обнаружения зависимостей (1) и (3) в 1662 году была получена экспериментальная зависимость между давлением газа р и его удельным объёмом υ при условии, что температура Т остаётся постоянной. Эта зависимость называется законом Бойля-Мариотта [4]:
р ∙ υ = С, при Т = const, (7)
где С – постоянная величина, значение которой не зависит от р и υ, Дж/кг.
Для определения уравнения состояния идеального газа, с учётом (5) – (7), необходимо определить, как зависит от температуры Т произведение давления газа р на его удельный объём υ в общем случае, когда одновременно могут изменяться все три параметра состояния р, υ и Т. То есть требуется определить вид функции f(T), которая равна:
f(T) = f[p(T), υ(T)] = p(T) ∙ υ(T). (8)
Вычислим по (8) производную от f по Т, как производную от сложной функции f[p(T), υ(T)]:
![]()
![]() . (9)
. (9)
Из (5) и (6) получим:
![]() ,
,![]() . (10)
. (10)
Подставляя (10) в (9) получаем:
![]() . (11)
. (11)
Оба слагаемых в правой части (11) не зависят от Т (при изменении Т их значения меняться не будут).
Введём обозначение:
![]() . (12)
. (12)
Очевидно, что R также не зависит от Т. После интегрирования (11) с учётом (12) получаем:
f(T) = R T + A, (13)
где А – постоянная интегрирования, значение которой можно определить с помощью (6).
Из (6) следует, что при Т = 0 значение р = 0, при условии, что υ = const. Для этого случая из (8) и (13) следует:
f(T) = p(T) ∙ υ(T) = 0 ∙ υ(T) = R ∙ 0 + А, т.е. А = 0. (14)
Докажем, с использованием (7), что R также не зависит от р и υ. Очевидно, что в случае когда температура Т принимает любое конкретное значение Tconst, то одновременно должны выполняться равенства (7) и (8):
р ∙ υ = В, при Т =Тconst, (15)
р ∙ υ = R ∙ Тconst, (16)
где В – некоторая размерная константа, Дж/кг.
Из (15) и (16) следует, что:
В
= R
∙ Тconst
или
![]() . (17)
. (17)
В (17) правая часть не зависит от р и υ при любых значениях Tconst, а значит от р и υ не зависит и R.
Таким образом, окончательно уравнение состояния идеального газа имеет вид:
р ∙ υ = R ∙ Т, (18)
где R – называется газовой постоянной, которая имеет для каждого газа своё постоянное значение, Дж/(кг∙К).
В 1874 году Менделеев преобразовал уравнение (18) к более удобному для многих расчётов виду. Для этого он привлёк дополнительные экспериментальные данные, относящиеся к закону Авогадро, точнее – к следствию из закона Авогадро для одного киломоля идеального газа при нормальных условиях (при температуре t = 0 С и давлении р = 1 атм = 760 мм рт. ст.= = 101325 Па).
Прежде чем сформулировать это следствие рассмотрим подробнее содержание и назначение понятия моль или киломоль (1 кмоль = 10 3 моль).
