
- •Физические основы
- •Введение
- •1. Термодинамическая система. Основные параметры состояния системы
- •2. Уравнение состояния идеального газа. Идеальная газовая смесь
- •3. Термодинамические процессы
- •4. Внутренняя энергия термодинамической системы
- •5. Энтальпия
- •6. Эквивалентность теплоты и работы. Историческая справка
- •7. Особенности процессов передачи энергии в форме теплоты и работы
- •8. Первый закон термодинамики для замкнутой термодинамической системы
- •9. Первый закон термодинамики в дифференциальном виде. Формула для расчёта механической работы при изменении объёма системы
- •10. Понятие теплоемкости
- •10.1. Общие сведения
- •10.2. Теплоёмкость газов
- •10.3. Теплоёмкость твёрдых и жидких тел
- •Значения температуры Дебая для некоторых веществ
- •11. Открытие энтропии
- •12. Второй закон термодинамики
- •13. Третий закон термодинамики
- •14. Основные соотношения для расчёта процессов в идеальном газе
- •15. Расчёт процессов в идеальном газе
- •15.1. Изохорный процесс
- •15.2. Изобарный процесс
- •15.3. Изотермический процесс
- •15.4. Адиабатный процесс
- •15.5 Политропный процесс
- •Значение показателя политропы n для основных термодинамических процессов в идеальном газе
- •Библиографический список
- •2.1. Уравнение Клапейрона
- •2.2. Понятие моль вещества
- •2.3. Закон Авогадро
- •2.4. Уравнение Клапейрона – Менделеева
- •3.1. Смеси идеальных газов
- •3.2. Парциальные давления в газовой смеси. Закон Дальтона
- •3.3. Приведённый объём компонента газовой смеси. Закон Амага
- •3.4. Химический состав газовой смеси
- •3.5. Газовая постоянная идеальной газовой смеси
- •3.6. Кажущаяся молярная масса идеальной газовой смеси
- •3.7. Удельный объём или плотность газовой смеси
- •3.6. Соотношение между массовыми и объёмными долями идеальной газовой смеси
- •4.1. Обратимые и равновесные процессы
- •5.1. Удельные объёмные и мольные теплоёмкости
- •5.2. Соотношения между удельными теплоёмкостями для газов и газовых смесей
- •5.3. Расчёт значений средних теплоёмкостей
- •5.4. Теплоёмкость смеси идеальных газов
- •6.1. Существование энтропии у реальных (не идеальных) газов
- •6.2. Существование энтропии у систем, находящихся в жидком или твёрдом состояниях
- •Оглавление
- •194021, Санкт-Петербург, Институтский пер., 5.
15. Расчёт процессов в идеальном газе
15.1. Изохорный процесс
Условие, определяющее изохорный процесс: υ = const или dυ = 0.
Изображение изохорного процесса в рυ – координатах представлено на рис. 15.1 а) и б).

а) б)
Рис. 15.1.Изображение изохорного процесса врυ– координатах:
а) с повышением давления; б) с понижением давления
Связь между параметрами состояния газа в начале и конце изохорного процесса получаем из уравнения состояния (14.1), записав его для точек 1 и 2:
 .
(15.1)
.
(15.1)
Разделив левые и правые части (15.1) друг на друга получаем:
![]() .
(15.2)
.
(15.2)
Для рассматриваемого случая общая система уравнений с дополнительным условием принимает следующий вид:
 (15.3)
(15.3)
Так как при условии υ = const неизвестная в общем случае удельная теплоёмкость процесса с превращается в известную (из справочника) удельную теплоёмкость при постоянном объёме сυ, то в системе (15.3) число неизвестных функций становится равным числу независимых уравнений. То есть система (15.3) становится однозначно разрешимой. Решение дифференциальных уравнений производится, как известно, путём их интегрирования.
После интегрирования второго уравнения (15.3) с учётом, что с = сυ (для наглядности здесь и далее будем считать удельные теплоёмкости сυ и ср постоянными величинами), будем иметь:
 ,
(15.4)
,
(15.4)
где Т1 и Т2 – температуры газа в начале и конце процесса соответственно, К.
После интегрирования третьего уравнения (15.3) получаем:
 ,
(15.5)
,
(15.5)
где υ1 и υ2 – удельные объёмы газа в начале и конце процесса соответственно (υ1 = υ2), м3/кг.
После интегрирования первого уравнения (15.3) получаем, с учётом (15.5):
![]() .
(15.6)
.
(15.6)
После интегрирования четвёртого уравнения (15.3) получаем:
 .
(15.7)
.
(15.7)
Выводы:
1) Из (15.2) следует, что в изохорном процессе отношение давлений равно отношению температур.
2) Из(15.5) следует, что в изохорном процессе работа не совершается (удельная работа равна нулю). (Так как при интегрировании уравнение идеального газа не использовалось, то этот вывод справедлив для всех случаев: идеального газа, реального газа, для вещества в твёрдой или жидкой фазах).
3) Из (15.6) следует, что в изохорном процессе вся теплота процесса идёт на изменение внутренней энергии газа. (Это также справедливо для всех случаев).
4) Из (15.7) следует, что в Ts – координатах изохорный процесс изображается логарифмической кривой рис. 15.2 а) и б).
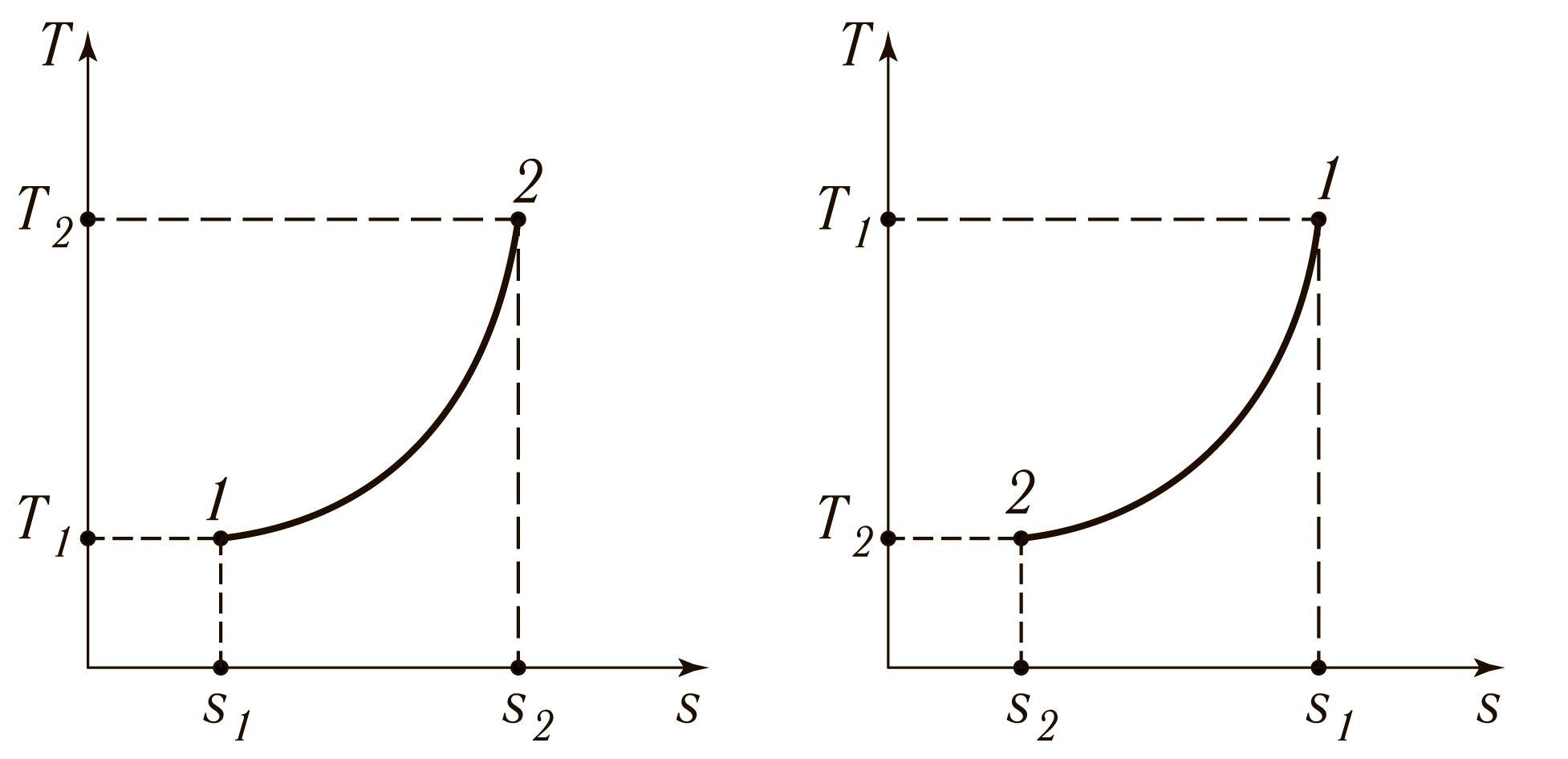
а) б)
Рис. 15.2.Изображение изохорного процесса вT s-координатах:
а) с подводом теплоты; б) с отводом теплоты
15.2. Изобарный процесс
Условие, определяющее этот процесс: р = const или dp = 0.
В pυ-координатах изображается горизонтальными линями на рис. 15.3.

а) б)
Рис. 15.3.Изобарный процесс 1 – 2 вр υ-координатах:
а) с увеличением удельного объёма (расширение); б) с уменьшением удельного объёма (сжатие)
Соотношение между параметрами состояния в ходе изобарного процесса определяется из уравнения состояния идеального газа. Запишем его для точек 1 и 2 – начала и конца изобарного процесса:
 .
(15.8)
.
(15.8)
Разделив левые и правые части (15.1) друг на друга получаем:
![]() .
(15.9)
.
(15.9)
Равенство (15.9) показывает, что в изобарном процессе отношение удельных объёмов равно отношению температур.
Исходная система уравнений (14.6) с дополнительным условием для изобарного процесса имеет вид:
 (15.10)
(15.10)
Благодаря последнему в (15.10) условию неизвестная в общем случае истинная удельная теплоёмкость с становится известной (из справочника) удельной теплоёмкостью ср при постоянном давлении. В результате в системе (15.3) число неизвестных функций становится равным числу независимых уравнений, и система становится однозначно разрешаемой.
В результате интегрирования второго уравнения в (15.10) получаем:
 .
(15.11)
.
(15.11)
В результате интегрирования третьего уравнения получаем:
 .
(15.12)
.
(15.12)
В результате интегрирования первого уравнения получаем:
![]() .
(15.13)
.
(15.13)
В результате интегрирования четвёртого уравнения получаем:
 .
(15.14)
.
(15.14)
Выводы:
1) Из (15.13) с учётом (15.12) и того, что р1 = р2, следует:
q = u2 – u1 +l = u2 – u1 +p1 · (υ2 – υ1) = u2 – u1 +p2 υ2 – p1 υ1 =
= (u2 +p2 υ2) – (u1 + p1 υ1) = i2 – i1, (15.15)
где i1 и i2 – удельные энтальпии газа в начале и конце изобарного процесса, Дж/кг.
Формула (15.15) показывает, что теплота в изобарном процессе расходуется на изменение удельной энтальпии системы. (В то время как в изохорном – на изменение удельной внутренней энергии).
С учётом (15.11) вместо (15.15) можем записать:
i2 – i1 = ср (Т2 – Т1). (15.16)
При известной ср выражение (15.16) позволяет построить таблицы для удельной энтальпии, как функции состояния.
2) Используя уравнение идеального газа из (15.12) получаем:
l = р1 · (υ2 – υ1) = p2 υ2 – p1 υ1 = RT2 – RT1 = R · (T2 – T1). (15.17)
Рассмотрим далее случай, когда (Т2 – Т1) = 1, К. Тогда из (15.17) будем иметь:
l = R · 1, Дж/кг. (15.18)
Равенство (15.18) показывает, что газовая постоянная численно равна работе одного килограмма газа в изобарном процессе при увеличении его температуры на один градус.
3) Из (15.14) следует, что изобарный процесс в T s-координатах является логарифмической кривой, рис. 15.4.

а) б)
Рис. 15.4.Изобарный процесс 1 – 2 вTs– координатах:
а) с подводом теплоты; б) с отводом теплоты
На рис. 15.4 для качественного сравнения в том же диапазоне температур пунктирной линией изображена изохора, которая идёт круче изобары.
