
- •Физические основы
- •Введение
- •1. Термодинамическая система. Основные параметры состояния системы
- •2. Уравнение состояния идеального газа. Идеальная газовая смесь
- •3. Термодинамические процессы
- •4. Внутренняя энергия термодинамической системы
- •5. Энтальпия
- •6. Эквивалентность теплоты и работы. Историческая справка
- •7. Особенности процессов передачи энергии в форме теплоты и работы
- •8. Первый закон термодинамики для замкнутой термодинамической системы
- •9. Первый закон термодинамики в дифференциальном виде. Формула для расчёта механической работы при изменении объёма системы
- •10. Понятие теплоемкости
- •10.1. Общие сведения
- •10.2. Теплоёмкость газов
- •10.3. Теплоёмкость твёрдых и жидких тел
- •Значения температуры Дебая для некоторых веществ
- •11. Открытие энтропии
- •12. Второй закон термодинамики
- •13. Третий закон термодинамики
- •14. Основные соотношения для расчёта процессов в идеальном газе
- •15. Расчёт процессов в идеальном газе
- •15.1. Изохорный процесс
- •15.2. Изобарный процесс
- •15.3. Изотермический процесс
- •15.4. Адиабатный процесс
- •15.5 Политропный процесс
- •Значение показателя политропы n для основных термодинамических процессов в идеальном газе
- •Библиографический список
- •2.1. Уравнение Клапейрона
- •2.2. Понятие моль вещества
- •2.3. Закон Авогадро
- •2.4. Уравнение Клапейрона – Менделеева
- •3.1. Смеси идеальных газов
- •3.2. Парциальные давления в газовой смеси. Закон Дальтона
- •3.3. Приведённый объём компонента газовой смеси. Закон Амага
- •3.4. Химический состав газовой смеси
- •3.5. Газовая постоянная идеальной газовой смеси
- •3.6. Кажущаяся молярная масса идеальной газовой смеси
- •3.7. Удельный объём или плотность газовой смеси
- •3.6. Соотношение между массовыми и объёмными долями идеальной газовой смеси
- •4.1. Обратимые и равновесные процессы
- •5.1. Удельные объёмные и мольные теплоёмкости
- •5.2. Соотношения между удельными теплоёмкостями для газов и газовых смесей
- •5.3. Расчёт значений средних теплоёмкостей
- •5.4. Теплоёмкость смеси идеальных газов
- •6.1. Существование энтропии у реальных (не идеальных) газов
- •6.2. Существование энтропии у систем, находящихся в жидком или твёрдом состояниях
- •Оглавление
- •194021, Санкт-Петербург, Институтский пер., 5.
Значение показателя политропы n для основных термодинамических процессов в идеальном газе
|
№ п/п
|
Наименование процесса |
Условие (свойство) процесса |
Вид условия политропы: p υn=const |
Значение n |
|
1 |
Изобарный |
p= const |
pυ0 = const (т.к. υ0= 1) |
n= 0 |
|
2 |
Изотермический |
T = constили pυ= const |
pυ1 = const |
n= 1 |
|
3 |
Адиабатный |
q= 0 (pυk = const) |
pυk = const |
n = k |
|
4 |
Изохорный |
υ = const |
pυn = const
|
n=
(т.к.
|
Данные таблицы 15.1 можно проиллюстрировать в рυ – координатах с помощью рис. 15.9, где изображены графики всех четырёх основных термодинамических процессов.
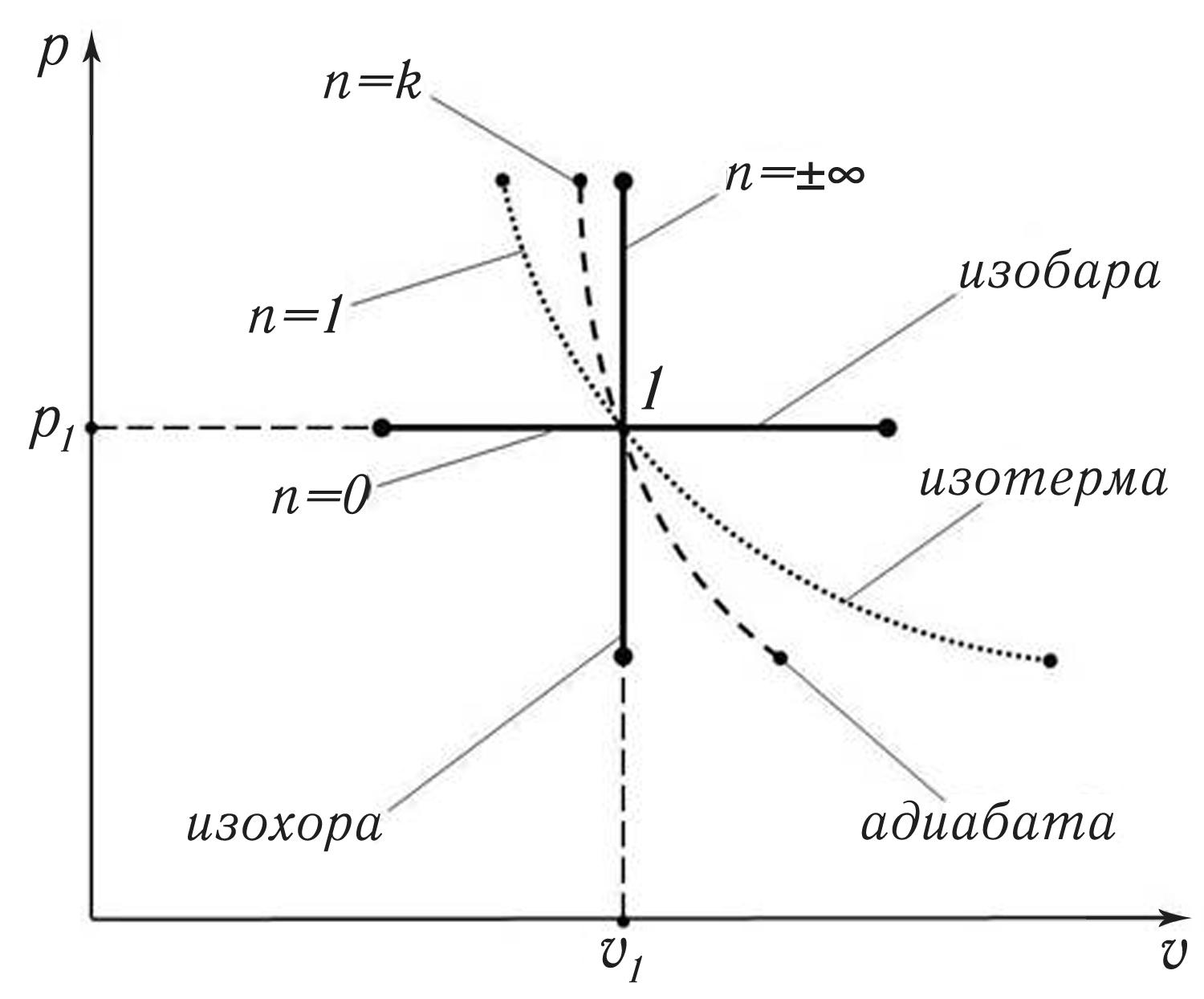
Рис. 15.9.Основные термодинамические процессы (табл. 15.1),
соответствующие значениям показателя политропы n
Из
рис. 15.9 видно, что положение графиков
на рυ
– плоскости монотонно меняется с ростом
значения показателя политропы n:
от горизонтальной линии, при n
= 0, до вертикальной – при n
=
![]() ∞.
∞.
Очевидно, что промежуточным значениям n на рис. 15.1 будут соответствовать промежуточные графики процессов. Например, если 0 < n < 1, то график политропы будет проходить между изобарой и изотермой.
Такое свойство позволяет с помощью политропного процесса описать в рυ – координатах отдельные участки у любого процесса, что часто применяется в расчётах.
Примечание:
Формула для удельной теплоёмкости идеального газа в политропном процессе (15.59) позволяет построить график зависимости с от показателя политропы n, которая имеет вид, приведённый на рис. 15.10.

Рис.15.10.Зависимостьсn
отn![]() :
:
ср,сυиk– удельные теплоёмкости при постоянном давлении, объёме и показателе адиабаты некоторого газа (например, азота) соответственно
Анализ графика на рис. 15.2 показывает:
• если n = k (адиабатный процесс), то cn = 0;
• если n < 1 и n > k, то cn >0;
• если 1 < n < k, то cn < 0;
• если n = 1 + 0 (изотермический процесс), то cn = +∞;
• если n = 1 – 0 (изотермический процесс), то cn = –∞;
Таким образом, видно, что у одного газа теплоёмкость существенно меняется в зависимости от того, в каком процессе к нему подводится (или отводится) теплота.
Библиографический список
1. Путилов, К.А. Термодинамика. / К.А. Путилов. – М.: Наука, 1971. – с. 375.
2. Ерошенко, В.А., Евтушенко, А.В. Существующий механический эквивалент теплоты. Является ли он фундаментальной константой? Интернет: iee.kpi.ua / files / 2009 ukr / 47.pdf/
3. История физики за последние столетие. Интернет: alxandr 4784.narod.ru/
4. Кириллин, В.А., Сычёв, В.В., Шейндлин, А.Е. Техническая термодинамика. / В.А. Кириллин [и др.]. – М.: Наука, 1976. – 512 с.
5. Теплотехнический справочник в двух томах. / Под ред. В.Н. Юренев, П.Д. Лебедев. Изд. 2-е, перераб. Т.1. – М.: Энергия, 1975 – 744 с.
6. Зоммеррельд, А. Термодинамика и статистическая физика. / Перевод с нем. В.Л. Бонг-Бруевича. – М.: Изд-во Иностранной литературы, 1955. – 479 с.
7. Ферми, Э. Термодинамика. / Перевод с англ. Б.А. Вайсмана. - Харьков.: Изд-во Харьковского университета, 1969. – 139 с.
8. Куинн, Т. Температура. / Перевод с англ. под ред. Д.Н. Астрова. – М.: Мир, 1985. – 448 с.
9. Базаров, И.П. Термодинамика. / И.П. Базаров. – М.: Высш. шк., 1983. – 344 с.
10. Крутов, В.И., Исаев, И.А. Техническая термодинамика. / В.И. Крутов [и др.]. – М.: Высш. шк., 1991. – 384 с.
11. Пригожин, И., Кондепули, Д. Современная термодинамика. От тепловых двигателей до диссипативных структур. / Пер с англ. Ю.А. Данилова и В.В. Белого. – М,: Мир, 2002. – 461 с.
12. Румер, Ю.Б., Рывкин, М.Т. Термодинамика статистическая физика и кинетика. / Ю.Б. Рдмер. – М.: Наука, 1977. – 552 с.
13. Сивухин, Д. В. Общий курс физики. В 5 т. Т. II. Термодинамика и молекулярная физика. / Д.В. Сивухин. 5-е изд., испр. – М.: ФИЗМАТЛИТ, 2005. – 544 с.
П Р И Л О Ж Е Н И Я
Приложение 1
По определению, д а в л е н и е – это сила, действующая на единицу площади поверхности по направлению нормали (перпендикулярно к плоскости поверхности). В системе СИ единицей давления является паскаль (Па) – это давление, вызываемое силой один ньютон (1 Н), равномерно распределенной по поверхности площадью 1 м2.
Абсолютное давление, например газа, на некоторую поверхность обусловлено ударами молекул газа об эту поверхность. При каждом ударе молекула газа действует на поверхность с определенной силой. Обратно направленная сила, с которой действует на молекулу поверхность сосуда, заставляет молекулу отражаться от неё.
Если бы в объёме содержалось всего несколько молекул, то их удары следовали бы друг за другом редко и беспорядочно и нельзя было бы говорить ни о какой регулярной силе давления, действующей на поверхность. Если же число молекул в объёме очень велико, то будет велико и число ударов их о поверхность. Бесконечно малые силы отдельных ударов складываются в конечную и почти постоянную силу, действующую на поверхность. Эта сила и есть абсолютное давление газа, которое рассматривается в термодинамике.
Из этого очевидно следует, что абсолютное давление не может быть отрицательным.
Абсолютное давление определяется по показаниям приборов (манометров и вакуумметров) и вычисляется по соотношению:
● при рабс > В: рабс = рман + В, (1)
где В – барометрическое (атмосферное) давление, Па; рман – манометрическое давление, показывающее избыток давления измеряемой среды над атмосферным давлением, Па;
● при рабс < В: рабс = В – рвак, (2)
где рвак – вакуумметрическое давление, которое ниже атмосферного. Оно показывает на сколько давление рассматриваемой среды меньше атмосферного (здесь вакуум трактуется как разрежение), Па.
Барометрическое – атмосферное давление определяется с помощью барометров.
Современные приборы позволяют определять давление с точностью до ±0,01 Па.
Температура – термин латинского происхождения. Означает смешение (холодного и горячего).
Считается, что первый прибор для наблюдения за измерениями температуры был изобретен примерно в 1597 году итальянским учёным Галилео Галилеем. Назывался он термоскоп. Термоскоп был выполнен в виде небольшого стеклянного шарика с припаянной к нему стеклянной трубкой. Функционировал термоскоп следующим образом. Вначале шарик нагревали. При этом нагревался и воздух, находящийся внутри шарика. Затем конец трубки опускали в воду. Через некоторое время воздух в шарике охлаждался до прежней температуры. Соответственно объём воздуха в шарике уменьшался и вода, под действием атмосферного давления, поднималась по трубке вверх на некоторую высоту. После этого термоскоп был готов к работе. Если температура окружающего воздуха, а значит и воздуха внутри шарика, изменялась, то изменялся и уровень воды в трубке. При потеплении температура и объём воздуха в шарике возрастали и соответственно уровень воды в трубке понижался. При похолодании наоборот – уровень воды повышался.
Таким образом, уже в первый измерительный прибор был заложен принцип, который широко применяется и сегодня: использовать для измерения температуры свойство тел изменять свой объём при изменении температуры.
В 17 веке термоскоп был усовершенствован флорентийскими учёными. В итоге прибор перевернули шариком вниз и заполнили его спиртом. Действие прибора основывалось на расширении спирта при нагревании.
В 1714 году голландский учёный Д.Г. Фаренгейт изготовил ртутный термометр. По преданию шкала строилась по двум реперным (базовым) точкам. Нижняя точка – это температура замерзания смеси воды, спирта и нашатыря (0 F). Верхняя – нормальная температура человеческого тела (100 F). В наше время интервал между нормальными точками плавления и кипения воды делится на 180 F. При этом в точке плавления принимается значение 32 F. Шкалой Фаренгейта пользуются в США, но постепенно и там она вытесняется шкалой Цельсия.
В 1730 году французский учёный Р.Ремюр описал изобретённый им спиртовой термометр со шкалой, которая делилась на 80-ть частей в интервале температур от таяния льда до кипения воды. Такое деление объяснялось тем, что спирт расширяется между этими точками в отношении 1000 : 1080.
В 1742 году шведский учёный А.Цельсий разделил этот же интервал на 100 частей, но принял за 100 С температуру таяния льда, за 0 С – температуру кипения воды (при давлении одна атмосфера).
В 1750 году шведский учёный Штремер «перевернул» шкалу Цельсия, и она приняла современный вид. Однако наименование «градус Цельсия» осталось.
В настоящее время в физике основной температурной шкалой является абсолютная термодинамическая шкала температур (АТШТ) (ее называют также шкалой Кельвина).
Она не зависит от индивидуальных свойств термометрического вещества (например, газа) и построена таким образом, что принципиально позволяет измерять любые температуры, как бы высоки или низки они ни были.
Строится АТШТ на том свойстве цикла Карно, что его термический КПД зависит только от температур нагревателя и холодильника (не зависит от конструкции машины Карно и от свойств используемого рабочего вещества).
Можно показать, что абсолютная термодинамическая шкала тождественна со шкалой идеально-газового термометра [13]. Поэтому от 4 до 1338 К (точка затвердевания золота) АТШТ практически осуществляется с помощью газового термометра.
Практически газовый термометр можно реализовать двумя способами. В одном способе объем газа поддерживается постоянным, а индикатором температуры служит давление. Во втором способе поддерживается постоянное давление газа, а измерение температуры сводится к измерению его объема. Принципиально оба способа равноправны. Но первый способ более удобен, а потому он и применяется на практике.
Газовый термометр находится вне конкуренции среди термометров другого типа по чувствительности, точности и воспроизводимости измерений.
На практике, для повышения точности измерений, давление в газовом термометре должно быть достаточно низким (атмосферное и ниже). Например, самая низкая температура, которая может быть измерена с помощью газового термометра, составляет примерно минус 272 С при условии, что термометр наполнен гелием при низком давлении [1].
Газовые термометры не пригодны для измерения очень высоких и очень низких температур.
При температурах более тысячи градусов многоатомные газы начинают диссоциировать, т.е. их молекулы распадаются на атомы. При еще более высоких температурах атомы ионизируются, т.е. распадаются на электроны и положительно заряженные ионы. Из-за этого в газах перестаёт выполняться линейная зависимость между температурой и давлением, даже при очень низком давлении.
При низких температурах все реальные газы, в конце концов конденсируются, что также нарушает эту линейную зависимость.
Устройство реального газового термометра и работа с ним довольно сложны. Термометры имеют большие размеры, громоздки и медленно приходят в состояние теплового равновесия. По этим причинам для технических целей они применяются редко. Редко они используются и в физических исследованиях, где с их помощью иногда измеряют низкие температуры.
Основное назначение газовых термометров состоит в том, что по ним градуируются другие термометры. В связи с этим газовые термометры называются первичными, а градуированные по ним термометры, применяемые при практических измерениях – вторичными. Не каждый вторичный термометр должен градуироваться непременно по газовому. Газовые термометры используются для градуировки главным образом в бюро стандартов, метрологических институтах и в некоторых исследовательских лабораториях. Обычно же для градуировки термометров применяются достаточно точные вторичные термометры.
На десятой генеральной конференции по мерам и весам (1954 год) было утверждено построение абсолютной термодинамической шкалы температур по одной реперной точке – тройной точке воды, и принято решение приписать этой точке температуру 273,16 К точно. (В тройной точке в фазовом равновесии сосуществует твердая, жидкая и газообразная фазы одного вещества).
Таким образом, в современной термодинамической шкале температур разность между температурами нормальных точек кипения воды и плавления льда равна 100 С лишь приближенно. Приближенными являются и значения самих температур этих точек, а именно 273,15 К и 373,15 К. Температура же тройной точки воды 273,16 является точной по определению. Она выбрана из-за того, что может быть воспроизведена в специальных приборах с наименьшей погрешностью, чем две другие.
Экспериментальные трудности измерения температуры по абсолютной термодинамической шкале привели к необходимости введения Международной практической температурной шкалы (МПТШ). При этом преследовалась цель создания такой температурной шкалы, которою легко и быстро можно было бы использовать для калибровки научных и технических приборов и которая в то же время воспроизводила бы термодинамическую шкалу с наибольшей возможной точностью, допускаемой современной техникой измерений. Единицами температуры в этой шкале являются Кельвин и градус Цельсия в зависимости от выбора начала отсчета температуры. Шкала несколько раз уточнялась. Последний раз это было сделано в 1968 году.
Международная практическая температурная шкала 1968 г. (МПТШ-68) основана на 12 хорошо воспроизводимых температурных точках, которым приписаны определенные значения температуры (первичные реперные точки). Температуры первичных реперных точек приведены в табл. 1 [2].
Таблица 1
Первичные реперные точки МПТШ-68
-
№
п/п
Наименование
точки
Температура
К
С
Опорная
1.
Тройная точка воды
273,16
0,01
Первичные
2.
Тройная точка водорода*)
13,81
– 259,34
3.
Точка кипения водорода*) при давлении 33,33 кПа (250 мм рт.ст)
17,042
– 256,108
4.
Точка кипения водорода*)
20,28
– 252,87
5.
Тройная точка кислорода
54,361
– 218,789
6.
Точка кипения аргона
83,798
– 189,352
7.
Точка кипения кислорода
90,188
– 182,962
8.
Точка кипения воды
373,15
100
9.
Точка затвердевания олова
505,1181
231,9681
10.
Точка затвердевания цинка
692,73
419,58
11.
Точка затвердевания серебра
1235,08
961,93
12.
Точка затвердевания золота
1337,58
1064,43
Примечание:
1. *) В экспериментах использовалась равновесная смесь орто- и параводорода.
Кроме электронных и колебательно-вращательных состояний молекулы водорода, для нее различают также состояния с одинаковым и противоположным по направлению вращением атомных ядер (параллельные и антипараллельные ядерные спины). В связи с этим имеются две модификации молекулярного водорода, несколько различные по физическим свойствам: ортоводород (параллельные спины) и параводород (антипараллельные спины), содержащиеся при обычных и высоких температурах в отношении 3:1; при понижении температуры равновесие сдвигается в сторону пароводорода, содержание которого при температурах глубокого холода приближается к 100 %.
2. За исключением температур тройных точек и Т = 17,042 К приведенные в этой таблице значения относятся к давлению в одну стандартную атмосферу.
Между первичными реперными точками температурная шкала устанавливается с помощью интерполяционных формул, дающих соотношение между температурой и показаниями стандартных термометров (платиновый термометр сопротивления, платинородиевая термопара, оптический пирометр), градуированным по этим точкам.
Вся область температур, охватываемая МПТШ-68, делится на ряд интервалов, в каждом из которых рекомендуются свои методы воспроизведения температур и свои интерполяционные формулы.
Современные способы измерения позволяют измерять температуру с точностью до ±0,001 С.
Примечание:
В англоязычных странах для термодинамических расчётов используется шкала шотландского физика Ранкина. Шкала Ранкина начинается при температуре абсолютного нуля. При нормальных условиях точка замерзания воды соответствует 491,67 Ra, точка кипения воды 671,67 Ra. Число градусов между точками замерзания и кипения воды по шкале Фаренгейта и Ранкина одинаково и равно 180. Соотношение между Кельвином и градусом Ранкина:
1 К = 1,8 Ra.
Градусы Фаренгейта переводят в градусы Ранкина по формуле
Ra = F + 459,67.
Приложение 2
