
ФОТП 2013
.pdf
Кафедра теплотехники и теплосиловых установок
А. А. Куликов, кандидат технических наук, доцент
И. Н. Дюкова, доцент
И. В. Иванова, кандидат технических наук, доцент А. Ф. Смоляков, кандидат технических наук, профессор
ФИЗИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ ЭНЕРГООБМЕНА
Учебное пособие для студентов очной и заочной форм обучения
Санкт-Петербург
2013
Рассмотрено и рекомендовано к изданию учебно-методической комиссией лесомеханического факультета Санкт-Петербургского государственного лесотехнического университета
15. января 2013 г.
Отв. редактор кандидат технических наук, доцент А. А. Куликов
Рецензенты:
отдел научно-технической информации и образовательной деятельности СПбНИИЛХ
(зав. отделом кандидат технических наук Н. А. Маятина), доцент Санкт-Петербургского государственного университета сервиса и экономики, кандидат технических наук В. Ф. Бадах
УДК 621.1
Куликов, А. А.
Физические основы процессов энергообмена: учебное пособие для студентов очной и заочной форм обучения / А. И. Куликов [и др.]. –
СПб.: СПбГЛТУ, 2013. – 103 с.
ISBN 978-5-9239-0476-5
Представлено кафедрой теплотехники и теплосиловых установок.
Восновной части учебного пособия строго и последовательно рассмотрены основные положения общей термодинамики. Особое внимание уделено аналитическому изучению процессов в газовой фазе.
Вобширных приложения к основному тексту более детально и углубл1нно излагаются вопросы специализированной направленности, которые в термодинамической теории выполняют вспомогательно-разъяснительную функцию, а также используются в практических расчётах.
Учебное пособие предназначено для студентов очной и заочной форм обуче-
ния.
Табл. 6. Ил. 10. Библиогр. 19 назв.
Темплан 2013 г. Изд. № 97. |
СПбГЛТУ, 2013 |
ISBN 978-5-9239-0476-5 |
2
ВВЕДЕНИЕ
Фундаментом, на котором строятся все теплофизические дисциплины, включая «Физические основы тепловых процессов» (ФОТП), является общая термодинамика (от греческого therme – теплота и dynamis – сила). Этимология слова указывает, что это наука «о силах, связанных с теплом», но вовсе не о движении тепла. Явления теплопередачи, теплопроводности классической термодинамики совсем не рассматриваются. Вопросы о быстроте или длительности процессов, то есть понятие о времени в нее не вводилось. Оно используется в настоящее время в одном из новых науч-
ных направлений – в термодинамике необратимых процессов.
Общая термодинамика изучает все физико-химические процессы на макроуровне, не опускаясь до изучения эффектов взаимодействия на атомном и молекулярном уровнях. То есть это феноменологическая наука, которая изучает явления в системах, состоящих из большого числа частиц (по-гречески феномен – это явление). При этом, там где это необходимо, термодинамика может привлекать молекулярно-кинетические представления для более детального объяснения сущности процессов.
1. Термодинамическая система. Основные параметры состояния системы
Все термодинамические процессы протекают в термодинамических системах.
Термодинамической системой называется совокупность материальных объектов, взаимодействующих как между собой, так и с окружающей средой.
Окружающая (или внешняя) среда – это все материальные объекты, находящиеся за границами термодинамической системы (для краткости – просто системы).
Примеры:
1.Термодинамической системой является газовая смесь, находящаяся
вцилиндре двигателя внутреннего сгорания.
Всё, что окружает молекулы газа в этой смеси, является окружающей средой: днище цилиндра, стенки цилиндра, поршень.
2. Термодинамической системой является работающий котельный агрегат (КА).
3
Всё, что находится вне его конструктивных элементов, является окружающей средой. Для того, чтобы себе это представить, мысленно окружаем КА поверхностью, внутри которой будут находится все его конструктивные элементы. Эту поверхность и можно рассматривать как границу данной термодинамической системы.
Однородная система состоит из одинаковых элементов (молекул, атомов).
В рассмотренных примерах первый вариант – это однородная система, второй – неоднородная.
Также системы бывают: однофазными или многофазными; однокомпонентными или многокомпонентными. (Система с двумя компо-
нентами называется бинарной или двойной – смесь двух газов, жидкостей или твёрдых тел и др.), с тремя компонентами – тернарной или тройной
и т.д.).
Например, смесь газов является однофазной, но многокомпонентной системой.
Взависимости от формы контакта с окружающей средой термодина-
мическая система может быть открытой, замкнутой, изолированной.
Открытая термодинамическая система может обмениваться с окружающей средой и веществом (частицами), и энергией.
Замкнутая – только энергией.
Изолированная – не может обмениваться с окружающей средой ни веществом, ни энергией.
Врассмотренных выше примерах: газовая смесь в цилиндре двигателя
–это замкнутая система, работающий котельный агрегат – открытая система.
Чтобы однозначно охарактеризовать состояние термодинамической системы используются параметры состояния.
Экспериментально установлено, что удобно пользоваться тремя ос-
новными параметрами состояния: абсолютная температура, абсолютное давление, удельный объем.
Абсолютная температура выражается в градусах Кельвина и определяется следующим выражением:
Т = t С + 273,15, К. |
(1.1) |
(Сам термин температура латинского происхождения. Он означает смесь, смешение – т.е. сочетание противоположных качеств – теплого и холодного. Термин градус также латинского происхождения и означает
ступень, степень).
4
Абсолютное давление в однородной системе выражается в паскалях и определяется как сила, действующая на 1 м2 по нормали к поверхности: р, Па.
Удельный объем – это отношение объема, который занимает однородная система, к ее массе:
υ |
V |
, м3 / кг, |
(1.2) |
|
M |
||||
|
|
|
где υ – удельный объём, м3/кг; V – объем системы, м3; М – масса системы, кг.
Например, в (1.2), это может быть отношение объема цилиндра двигателя, в котором находится смесь газов, к массе этой смеси.
Из определения удельного объема следует, что эта величина обратная плотности.
(Более подробнее сведения о параметрах состояния см. Приложение 1).
Если каждый из параметров состояния (р, υ, Т) термодинамической системы в каждой точке объема, который она занимает, имеет одно свое неизменное значение, то система находится в состоянии равновесия.
В результате обобщения опытных данных формулируется первый, или основной постулат термодинамики:
у изолированной системы существует состояние термодинамического равновесия, в которое она приходит с течением времени и никогда самопроизвольно выйти из него не может.
Замечание:
Анализ процессов, происходящих в изолированной системе, представляет интерес в большой мере потому, что в предельном обобщении любую неизолированную систему и окружающую её среду можно рассматри-
вать как единую изолированную систему.
При изучении свойств равновесных систем термодинамика прежде всего рассматривает свойства простых систем.
Простыми называются однофазные системы с постоянным числом частиц, состояние которых определяется только температурой Т и ещё ка- ким-то одним параметром состояния, например, давлением р.
5
Замечание:
В связи со сказанным выше всюду далее рассматриваться будут только простые системы, за исключением особо оговориваемыхх случаев.
2. Уравнение состояния идеального газа. Идеальная газовая смесь
Уравнение состояния термодинамической системы определяется экспериментально. Оно показывает, каким образом в любом равновесном состоянии системы ее параметры р, υ, Т связаны между собой.
Идеальным газом в термодинамике считается газ, у которого параметры состояния связаны между собой соотношением:
p υ = R T, |
(2.1) |
где р, υ, и Т – абсолютное давление, Па, удельный объем, м3/кг, и абсолютная температура, К, газа; R – газовая постоянная – экспериментально определенная константа, имеющая свое постоянное значение у каждого газа, Дж/(кг · К).
Выражение (2.1) называется уравнением Клапейрона. Из (2.1) путем преобразований можно получить уравнение Клапейрона-Менделеева, привлекая для этого данные из следствия закона Авогадро (подробнее см. Приложение 2):
p υ = |
Rμ |
T, |
(2.2) |
|
μ |
||||
|
|
|
где Rμ – универсальная газовая постоянная, Rμ = 8,314 Дж/(моль · К); μ – молярная масса газа (всегда известная величина, т.к. всегда известно для какого газа ведется расчет), кг/моль.
Уравнение (2.1) или (2.2) называется уравнением состояния идеального газа, так как, зная любые два параметра состояния, из них всегда можно определить третий.
Экспериментально установлено, что для большинства газов и газовых смесей в достаточно широком диапазоне давлений и температур уравнения (2.1) и (2.2) можно считать справедливыми.
Идеальной газовой смесью называется смесь, состоящая из идеальных газов. Для такой смеси все термодинамические расчеты выполняются аналогично расчетам для идеальных газов. (Расчет характеристик газовых смесей приводится в Приложении 3).
6
Примечание:
1)Из уравнения (2.1) и (2.2) следует, что из трех параметров состояний р, υ, и Т независимыми являются только два, но любые.
Это свойство параметров состояния, как показывают эксперименты, характерно также для простых термодинамических систем, находящихся как в твердом, так и в жидком состояниях. То есть для однозначного определения состояния и характеристик термодинамической системы достаточно знать любые два из трех ее параметров состояния.
2)Формулы (2.1) и (2.2) позволяют проводить расчёты для чистых идеальных газов. Однако если расчёты проводятся для смеси, состоящей из идеальных газов, то этими зависимостями также можно пользоваться, записав их в виде:
pсм υсм = Rсм Tсм |
(2.1*) |
|||
или |
Rμ |
|
|
|
pсмυсм |
Tсм , |
(2.2*) |
||
|
||||
|
μсм |
|
||
где pсм, Tсм и υсм – абсолютное давление смеси, Па, температура смеси, К, и удельный объём смеси (величина обратная плотности смеси), м3/кг, соответственно; Rсм – газовая постоянная смеси, Дж/(кг · К); μсм – кажущаяся молярная масса смеси, кг/моль.
Значения, входящих в (2.1*) и (2.2*) величин υсм, Rсм, μсм, определяются по всегда заданному в расчётах химическому составу газовой смеси (подробнее см. Приложение 3).
3) Уравнение состояния идеального газа достаточно хорошо описывает поведение реальных газов при высоких температурах и относительно низких давлениях. Однако, когда температура и давление таковы, что газ близок к конденсации, то формула (2.1) приводит к весьма неточным результатам. Для таких случаев необходимо пользоваться другими уравнениями состояния реальных газов.
Одним из первых примеров уравнения состояния реальных газов является уравнение, предложенное в 1873 году голландским физиком Ван-дер- Ваальсом:
( p |
a |
)(υ b) RT , |
(2.3) |
|
|||
|
υ2 |
|
|
7

где a и b – по мысли Ван-дер-Ваальса размерные константы, имеющие своё значение для каждого вещества, не зависящее от температуры, плотности и давления.
Как видно из (2.3) это уравнение отличается от уравнения Клапейрона (2.1) двумя поправками: объёмной поправкой b и поправкой на так на-
зываемое внутреннее давление υa2 .
Для разряжения газов (когда поправка υa2 мала в сравнении с «р» и
когда «b» мало в сравнении с «υ») уравнение (2.3) совпадает с уравнением идеального газа (2.1). Для сжатых газов уравнение (2.3) обычно оказывается неточным. Исследование показали, что в действительности «a» и «b» являются функциями температуры и объёма.
Главная ценность уравнения (2.3) в том, что качественно оно не теряет смысла при переходе к жидкому состоянию.
Для реальных газов имеются и другие уравнения состояния. В общем
виде их можно представить функциональной зависимостью вида: |
|
F(p, υ, T) = 0. |
(2.4) |
где F – некоторая непрерывная функция трёх переменных p, υ и T. Общую зависимость (2.4) можно представить в более удобном для
дальнейшего анализа реальных газов виде:
p = f (υ, T), |
(2.5) |
где f – некоторая непрерывная функция двух переменных υ и T, получить вид которой для конкретного газа и определённых условий можно экспериментальным путём.
Выражение (2.5) можно рассматривать как общую форму записи уравнения состояния некоторого реального (не идеального) газа.
3. Термодинамические процессы
Как уже отмечалось выше, система находится в состоянии равновесия если во всех точках ее объема параметры состояния р, υ, и Т имеют одинаковые значения.
Если по каким-то причинам изменяется хотя бы один параметр состояния системы, то происходит термодинамический процесс.
8
Например, когда в цилиндре дизельного двигателя сжимается воздух – возрастают его давление и температура и уменьшается его удельный объем. В этом случае говорят: с воздухом происходит термодинамический процесс или в воздухе происходит термодинамический процесс.
Все термодинамические процессы можно разделить на два класса:
равновесные и неравновесные.
Равновесный процесс характеризуется тем, что все части системы во время такого процесса в каждый момент времени имеют одинаковые значения параметров состояния. То есть система в ходе такого процесса в каждый момент времени находится в состоянии равновесия, хотя изменение ее параметров состояния происходит. Каждый параметр изменяется так медленно, что во всем объеме системы это происходит одновременно.
Примечание:
1)На практике к равновесным процессам приближаются относительно медленные процессы.
2)В литературе равновесные процессы иногда называются квазирав-
новесными или обратимыми (подробнее об этом см.Приложение 4).
Все остальные процессы, для которых условия, сформулированные выше, не выполняется, называется неравновесными (необратимыми).
Таким образом, внутри системы параметры состояния (р, υ, и Т) могут изменяться двумя способами:
•параметр одинаково изменяется во всем объеме;
•в различных областях объема параметр меняется по-разному. Процессы первого типа называются равновесными, второго – нерав-
новесными.
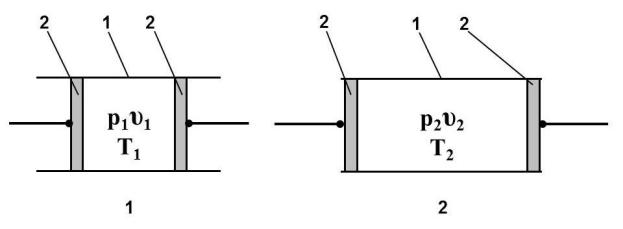
В качестве примера термодинамического процесса рассмотрим процесс расширения идеального газа в теплоизолированном канале 1 с подвижными поршнями 2, рис. 3.1. Однородной термодинамической системой в этом примере является газ, заключенный между двумя подвижными поршнями. Начальные равновесные состояния системы (и здесь и далее) характеризуется цифрой 1, конечное – 2.
Соответственно начальное равновесное состояние газа характеризуется значениями параметров состояния р1, υ1 и Т1, конечное равновесное со-
стояние – р2, υ2 и Т2.
Расширение газа от υ1 до υ2 может быть осуществлено двумя принципиально отличающимися способами. При очень медленном движении поршней процесс будет приближаться к равновесному расширению. При
9
очень быстром – к сугубо неравновесному расширению в пустоту до опре-
деленного удельного объема.
Рис. 3.1. Пример термодинамического процесса
Впервом случае температура газа понизится Т2 < Т1. Во втором останется неизменной Т2 = Т1.
Пояснить такое поведение температуры можно исходя из модели идеального газа, в котором он представляется состоящим из молекул – упругих сфер. В первом случае молекулы газа сталкиваются с удаляющимися от них поверхностями – поршнями. В результате упругого удара о такую движущуюся поверхность скорость молекул будет уменьшаться. Соответственно будут уменьшаться суммарная кинетическая энергия газа и его температура. Во втором случае молекулы всегда сталкиваются только с неподвижными поверхностями. Соответственно их скорость после таких упругих столкновений не изменяется, а значит, не изменяется суммарная кинетическая энергия газа и его температура. Дело в том, что молекулы не могут «догнать» быстрые поршни во время их перемещения на новые позиции. Таким образом, столкновений молекул с движущимися поверхностями не происходит.
Витоге можно констатировать, что идеальный равновесный процесс протекает при бесконечно медленном изменении параметров состояния. Только в этом случае во всей системе параметры будут изменяться строго одинаково.
Расчетные формулы в классической термодинамике выводятся именно для таких процессов. Однако, этими формулами можно пользоваться для реальных процессов, в которых параметры изменяются с конечными скоростями, например, при сжатии воздуха в дизельном двигателе. Как показывают оценки, в большинстве случаев ошибкой, которая появляется из-за этой конечности скоростей, можно пренебречь.
10
