
ФОТП 2013
.pdf
|
|
|
du dq dl, |
|
|
dq c dT , |
|
|
|
|
|
dl p dυ, |
|
(15.3) |
|
||
dq |
|
|
|
|
|
ds T , |
|
|
|
|
|
p const. |
|
|
|
|
|
Благодаря последнему в (15.3) условию неизвестная в общем случае истинная удельная теплоёмкость с становится известной (из справочника) удельной теплоёмкостью ср при постоянном давлении. В результате в системе (15.3) число неизвестных функций становится равным числу независимых уравнений, и система становится однозначно разрешаемой.
В результате интегрирования второго уравнения в (15.3) получаем:
2 |
T2 |
T2 |
|
|
|
|
dq |
q |
с p dt |
c p dT |
c p (T2 |
T1 ) . |
(15.4) |
1 |
T1 |
|
T1 |
|
|
|
В результате интегрирования третьего уравнения получаем:
2 |
|
υ2 |
|
υ2 |
|
|
|
dl |
l |
|
pd υ |
p1 dυ p1 |
(υ2 |
υ1 ) . |
(15.5) |
1 |
|
υ1 |
|
υ1 |
|
|
|
В результате интегрирования первого уравнения получаем:
2 |
|
2 |
2 |
|
du u 2 |
u1 |
dq dl q l . |
(15.6) |
|
1 |
|
1 |
1 |
|
В результате интегрирования четвёртого уравнения получаем:
2 |
T2 dq |
T2 c p dT |
T2 dT |
T |
|
|||||
ds s2 s1 |
|
T |
|
|
c p |
T |
c p ln( |
2 |
) . |
(15.7) |
T |
T |
|||||||||
1 |
T |
|
T |
|
T |
|
1 |
|
|
|
|
1 |
|
1 |
|
1 |
|
|
|
|
|
Выводы:
1) Из (15.6) с учётом (15.5) и того, что р1 = р2, следует:
q = u2 – u1 +l = u2 – u1 +p1 · (υ2 – υ1) = u2 – u1 +p2 υ2 – p1 υ1 =
= (u2 +p2 υ2) – (u1 + p1 υ1) = i2 – i1, |
(15.8) |
51
где i1 и i2 – удельные энтальпии газа в начале и конце изобарного процесса, Дж/кг.
Формула (15.8) показывает, что теплота в изобарном процессе расходуется на изменение удельной энтальпии системы. (В то время как в изохорном – на изменение удельной внутренней энергии).
С учётом (15.4) вместо (15.8) можем записать:
i2 – i1 = ср (Т2 – Т1). |
(15.9) |
При известной ср выражение (15.9) позволяет построить таблицы для удельной энтальпии, как функции состояния.
2) Используя уравнение идеального газа из (15.5) получаем:
l = р1 · (υ2 – υ1) = p2 υ2 – p1 υ1 = RT2 – RT1 = R · (T2 – T1). (15.10)
Рассмотрим далее случай, когда (Т2 – Т1) = 1, К. Тогда из (15.10) будем иметь:
l = R · 1, Дж/кг. |
(15.11) |
Равенство (15.11) показывает, что газовая постоянная численно равна работе одного килограмма газа в изобарном процессе при увеличении его температуры на один градус.
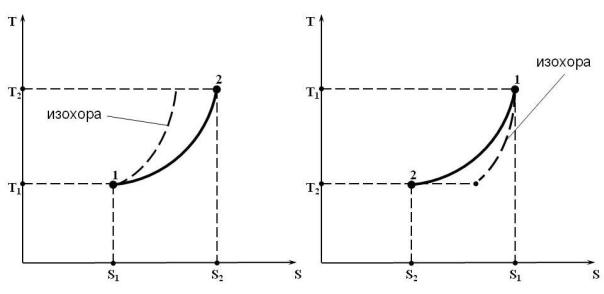
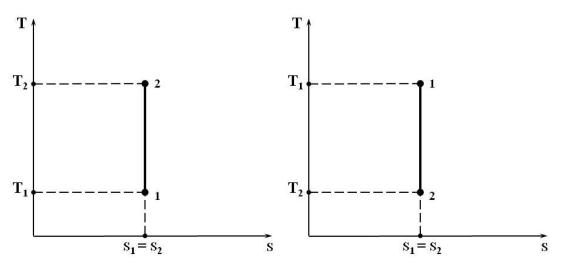
3) Из (15.7) следует, что изобарный процесс в T s-координатах является логарифмической кривой, рис. 15.4.
Рис. 15.4. Изобарный процесс 1 – 2 в T s-координатах: а) с подводом теплоты; б) с отводом теплоты
52
На рис. 15.4 для качественного сравнения в том же диапазоне температур пунктирной линией изображена изохора, которая идёт круче изобары.
15.3. Изотермический процесс
Условие, определяющее этот процесс: Т = const или dT = 0.
Примечание:
Как уже отмечалось, из эксперимента известно, что у идеальных газов удельная внутренняя энергия зависит от температуры u = u(T). То же относится к удельной энтальпии, так как:
i = u (T) +p υ = u (T) + RT.
Из этого следует, что изотермический процесс одновременно является процессом при постоянных удельных внутренней энергии и энтальпии идеального газа.
Соотношение между параметрами состояния в изотермическом процессе определяется из уравнения состояния идеального газа. Запишем его для точек 1 и 2 – начала и конца изотермического процесса.
p υ |
RT |
|
(15.12) |
1 1 |
1 |
. |
|
p2υ2 RT2 |
|
|
|
Разделив обе части (15.12) друг на друга получаем:
p1 |
|
υ2 |
. |
(15.13) |
|
|
|
||||
p |
2 |
|
υ |
|
|
|
|
1 |
|
|
|
Из (15.13) следует, что при изотермическом процессе давление и удельный объём обратно пропорциональны друг другу. То есть в р υ-координатах графиком изотермического процесса – изотермой является равнобокая гипербола, для которой координатные оси служат асимптотами, рис. 15.5.
53
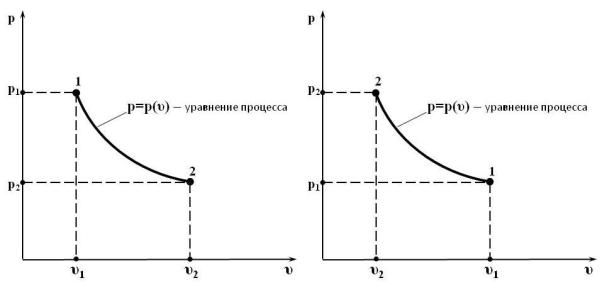
Рис. 15.5. Изотермический процесс 1 – 2 в р υ-координатах: а) расширение газа; б) сжатие газа
Для определённости будем считать, что в ходе изотермического процесса Т = сonst = Т1. Тогда для любой промежуточной точки процесса 1 – 2 можем записать уравнение состояния идеального газа:
p υ = R T1 или |
p |
RT1 |
. |
(15.14) |
|
||||
|
|
υ |
|
|
Выражение (15.14), вытекающее из условия Т = const, является уравнением изотермического процесса, которое можно добавить к исходной системе уравнений (15.6). В итоге система уравнений для изотермического процесса имеет вид:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
du dq dl, |
|
|||
dq c dT , |
|
|
||
dl p dυ, |
|
(15.15) |
||
|
||||
|
dq |
|
|
|
|
|
|
||
ds T , |
|
|||
|
|
|||
1 |
|
|
|
|
|
RT1 |
|
|
|
p |
. |
|
|
|
|
|
|||
|
υ |
|
|
|
В результате интегрирования первого уравнения в (15.15) получаем:
54
2 |
|
2 |
2 |
|
du u 2 |
u1 |
0 dq dl q l или q = l. |
(15.16) |
|
1 |
|
1 |
1 |
|
В результате интегрирования третьего уравнения, с учётом последнего, получаем:
2 |
l |
υ 2 |
|
|
|
|
υ 2 |
RT |
1 d υ |
|
|
dl |
pd υ |
|
|
υ |
|
||||||
1 |
|
υ1 |
|
|
|
|
υ1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
υ2 |
dυ |
|
|
|
|
υ2 |
|
|
|
|
RT1 |
RT1 |
|
|
|
(15.17) |
|||||
|
υ |
|
|
||||||||
|
ln |
υ |
. |
||||||||
|
|
υ |
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
В результате интегрирования четвёртого уравнения получаем:
2 |
2 dq |
1 |
2 |
q |
|
|||
ds s2 s1 |
|
T |
|
|
dq |
|
. |
(15.18) |
T |
T |
|||||||
1 |
1 |
1 |
1 |
1 |
1 |
|
|
|
Выводы:
1) Из (15.16) следует, что в изотермическом процессе:
•вся теплота, подводимая к газу, полностью превращается в работу расширения;
•при сжатии газа, от него отводится теплота в количестве, равном работе, затраченной на сжатие.
2) Из (15.16) и (15.17), с учётом (15.13), получаются следующие расчётные формулы:
|
|
υ |
2 |
|
|
|
p |
|
|
|
q l RT1 |
|
|
|
RT1 |
|
|
1 |
|
(15.19) |
|
υ |
p |
|
||||||||
ln |
|
ln |
|
. |
||||||
|
|
|
1 |
|
|
|
|
2 |
|
|
3) Из (15.18), с учётом (15.19), следует:
|
|
|
υ |
2 |
|
|
p |
|
|
s2 |
s1 |
|
|
|
|
|
1 |
|
|
υ |
|
|
|||||||
R ln |
|
R ln p |
2 |
. |
|||||
|
|
|
|
1 |
|
|
|
|
|
В Ts-координатах изотермический процесс изображается горизонтальной линией, рис. 15.6.
55
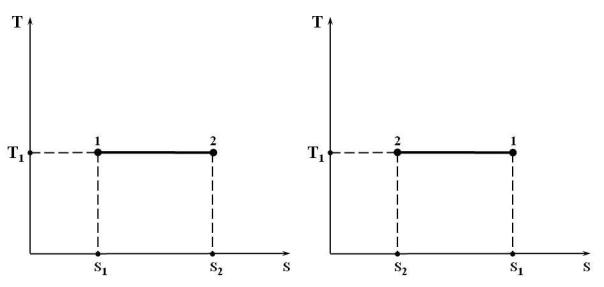
Рис. 15.6. Изотермический процесс 1 – 2 в T s-координатах:
а) с подводом теплоты (расширение газа); б) с отводом теплоты (сжатие газа)
15.4. Адиабатный процесс
Условие, которым определяется адиабатный процесс: q = 0.
Процесс, происходящий без теплообмена с окружающей средой на-
зывается адиабатным.
Условие отсутствия подвода и отвода теплоты к системе называется
условием адиабатности процесса.
На практике к адиабатным процессам приближаются такие процессы, в которых теплообменом между рассматриваемой системой и окружающей средой можно пренебречь.
Пренебречь теплообменом системы с окружающей средой можно в двух основных случаях: во-первых, если создать вокруг системы эффективную теплоизоляцию; во-вторых, если термодинамический процесс протекает достаточно быстро, в результате чего система за время процесса не успевает не получить из окружающей среды, ни передать ей сколько-нибудь значительно количество теплоты по сравнению с работой, совершаемой в данном процессе.
Исходная система уравнений (15.6) для адиабатного процесса с дополнительным условием имеет вид:
56
du dq dq c dl p
ds dqT q 0.
|
|
|
dl, |
|
|
dT , |
|
|
|
|
|
dυ, |
|
(15.20) |
|
||
|
|
|
, |
|
|
|
|
|
|
|
|
|
|
|
Первые два уравнения и последнее условие, с учётом свойства идеального газа (………), позволяют записать:
du + dl = cυ dT + p dυ = 0. |
(15.21) |
||||||
Подставляя в (15.21) давление р, выраженное из уравнения состояния |
|||||||
идеального газа, получаем: |
|
|
|
|
|
|
|
|
cυdT RT dυ 0 . |
(15.22) |
|||||
|
|
|
|
|
υ |
|
|
Преобразуем (15.22) к виду: |
|
|
|
|
|
|
|
|
dT |
|
R |
dυ 0. |
(15.23) |
||
|
T |
|
|||||
|
|
cυ |
υ |
|
|||
После интегрирования (15.23) получаем: |
|
||||||
lnT |
R |
ln υ const. |
(15.24) |
||||
|
|||||||
|
cυ |
|
|
|
|
|
|
Воспользовавшись уравнением Майера (……..) преобразуем отноше-
ние |
R |
к виду: |
|
|
|
|
||||
cυ |
|
|
c p cυ |
|
|
|||||
|
|
|
|
|
R |
|
k 1, |
(15.25) |
||
|
|
|
|
|
cυ |
cυ |
||||
|
|
|
|
|
|
|
|
|||
где k |
c p |
называется показателем адиабаты (безразмерная величина). |
||||||||
cυ |
||||||||||
|
|
|
|
|
|
|
|
|
||
57
С учетом (15.25) преобразуем (15.24) к виду: |
|
|
|
|
|
|
|
|||||||||||
|
|
|
ln T |
υ |
k 1 |
|
|
|
|
|
|
|
|
|
(15.26) |
|||
|
|
|
|
|
const . |
|
|
|
|
|
||||||||
Очевидно, что из (15.25) следует: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
T υ k 1 |
const . |
|
|
|
|
|
|
|
(15.27) |
||||||
Преобразуем (15.27) следующим образом, учитывая уравнение иде- |
||||||||||||||||||
ального газа: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T υ |
k 1 |
|
p(k 1) |
|
T (υ p)k 1 |
|
T (R T )k 1 |
|
|
|
|
|
|
|||||
|
p(k 1) |
|
|
p(k 1) |
|
|
p(k 1) |
const |
, |
|||||||||
|
|
|
|
|
||||||||||||||
или |
|
|
T T (k 1) |
|
|
T k |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
const |
|
|
|
|
|
|
|||||
|
|
|
p(k 1) |
p(k 1) |
|
|
R const |
|
. |
(15.28) |
||||||||
|
|
|
|
|
|
|||||||||||||
Выражение (15.28) возводим в степень 1k . В результате получаем:
|
|
|
|
T |
|
|
|
const |
|
. |
|
(15.29) |
|
|
|
|
|
(k 1) |
|
|
|
|
|||||
|
|
|
|
p k |
|
|
|
|
|
|
|
|
|
Выразим Т из уравнения состояния идеального газа и подставим в |
|||||||||||||
(15.27): |
|
|
|
|
|
|
|
p υk |
|
|
|
|
|
|
p υ |
|
k 1 |
|
|
|
|
|
|
|
|||
|
R υ |
|
|
|
|
R const |
|
||||||
|
|
|
|
|
|
||||||||
или |
p υk |
|
|
|
|
|
|
|
|
||||
|
|
|
|
R const const. |
(15.30) |
||||||||
Выражения (15.27), (15.29) и (15.30) показывают, как параметры состояния идеального газа (газовой смеси) связаны между собой во время адиабатного процесса. (Вспомним, что для изотермического процесса аналогичная связь имеет вид: р υ = const). В частности, выражение (15.30) справедливо как для начального, так и конечного состояния системы в точках 1 и 2:
58
p |
υk |
const и |
p |
2 |
υk const, |
1 |
1 |
|
|
2 |
отсюда следует, что
p1 υ1k p2 υ2k .
Аналогичным образом из (15.27) и (15.29) получаем:
(k 1) |
|
|
|
(k 1) |
|
|
T |
|
υ |
2 |
|
(k 1 ) |
|||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|||||||||
T1 υ1 |
|
T2 |
υ2 |
|
|
или |
|
|
|
|
|
|
|
|
, |
||||||
|
|
|
|
T |
2 |
υ |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|||
|
|
T |
|
|
|
T |
|
|
T |
|
|
|
p |
|
|
|
k 1 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
k |
|
|||||||||
|
|
|
1 |
|
|
|
|
2 |
или |
1 |
|
|
|
1 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
(k 1) |
|
|
(k 1) |
T2 |
|
p2 |
. |
||||||||||||
|
p |
|
k |
|
|
p |
|
k |
|
|
|
|
|
||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
(15.31)
(15.32)
(15.33)
Уравнение (15.30) называется уравнением адиабаты, которое говорит о том, что в ходе адиабатного процесса произведение давления на удельный объём в степени k остаётся постоянным.
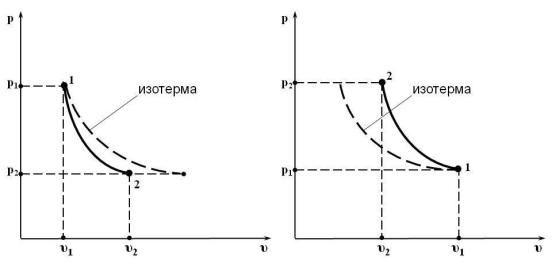
Из уравнения адиабаты (15.30) следует, что в р υ-координатах адиабатный процесс отображается степенной функцией вида p constυk :
Рис. 15.7. Адиабатный процесс 1 – 2 в р υ-координатах: а) расширение газа; б) сжатие газа
На рис. 15.7 пунктирной линией изображена изотерма (равнобокая гипербола). Очевидно, что график адиабаты круче графика изотермы.
В результате интегрирования (15.21) получаем:
59
2 |
2 |
T |
du dl 2cυ dT l 0, |
||
1 |
1 |
T1 |
или, с учётом (15.25):
T |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
|
l 2cυ dT cυ 2 dT cυ (T2 |
T1 ) cυ (T1 |
T2 ) |
|
|
|
|
|
(T1 T2 ) . (15.34) |
|||||||||||||||||||||||
|
k |
1 |
|||||||||||||||||||||||||||||
T1 |
T1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Формулу (15.34), используя уравнение идеального газа, можно преоб- |
|||||||||||||||||||||||||||||||
разовать к виду: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RT |
|
|
T |
2 |
|
p υ |
|
|
|
T |
2 |
|
|
|
|
|
|||||||||||
|
|
l |
|
1 |
|
|
|
|
|
|
1 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
(k 1) |
|
T |
(k 1) |
|
|
|
T |
|
|
|
(15.35) |
||||||||||||||||||
|
|
1 |
|
|
1 |
|
|
, |
|
||||||||||||||||||||||
или |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|||
|
1 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
RT |
RT |
2 |
|
|
|
p υ |
p |
2 |
υ |
2 |
. |
(15.36) |
||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
(k 1) |
|
1 |
|
|
|
|
(k |
1) |
|
|
1 |
1 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Выводы:
1) Из (15.34) следует, что в адиабатном процессе работа совершается только за счёт уменьшения внутренней энергии.
2) Из последнего условия q |
= 0 следует, что dq = 0, а значит |
ds dq 0 . Это означает, что s = |
const, т.е. в адиабатном процессе эн- |
T |
|
тропия не изменяется. |
|
Рис. 15.8. Адиабатный процесс в T s-координатах
60
