
ФОТП 2013
.pdfлучает от окружающей среды. (Термин «получает» здесь следует понимать в алгебраическом смысле, т.е. и «получает», и «отдаёт»). Таким образом слагаемые в правой части (8.1) могут иметь как положительные, так и отрицательные значения.
Общее правило знаков для Q и L можно сформулировать следующим образом: если энергия подводится к системе, то в правую часть (8.1) она входит со знаком плюс, если отводится – со знаком минус.
Можно констатировать, что (8.1) является уравнение баланса внутренней энергии системы. Бытовым аналогом такого баланса можно считать «баланс кошелька», когда поступающие в кошелёк деньги учитываются со знаком плюс, а уходящие из кошелька – со знаком минус.
Для краткости изложения в дальнейшем будем иногда использовать традиционные термины теплота и работа, всегда помня, что речь идёт о передачи энергии по определенному механизму в ходе некоторого процесса.
Обычно в термодинамике выражение (8.1) записывают для удельных величин. Для этого обе части (8.1) разделим, например, на массу системы
М, кг:
u2 – u1 = q – l, |
(8.2) |
где u2 – u1 – изменение удельной внутренней энергии системы, Дж/кг; q – удельная теплота процесса, Дж/кг; l – удельная работа процесса, Дж/кг.
Примечание:
1)В круг важнейших задач, которые призвана решить термодинамика, входит задача по определению значений q и l, входящих в (8.2), для различных, актуальных для практики процессов.
2)Уравнение (8.1) можно записать в виде:
Q = U2 – U1 + L. |
(8.1*) |
Такую запись можно интерпретировать следующим образом: теплота, подведённая к системе, в общем случае расходуется на изменение её внутренней энергии и совершение механической работы. (Именно такой процесс рассматривается в разделе 7 в качестве примера).
21
9. Первый закон термодинамики в дифференциальном виде. Формула для расчёта механической работы
при изменении объёма системы
Выражение (8.2) можно рассматривать как интегральную форму записи первого закона термодинамики.
Анализировать различные термодинамические процессы удобно, если пользоваться не интегральной, а дифференциальной формой записи первого закона термодинамики. В частности, это даёт возможность рассчитывать величину l – удельную работу процесса или, более строго, удельную энергию, подведённую к системе или отведённую от неё в форме механической работы.
Дифференциальная форма записи справедлива только для равновесных процессов. Рассмотрим её вывод из (8.2) для произвольного равновесного процесса изменения объёма некоторой термодинамической системы. Такой системой, в частности, может быть некоторый объём газа.
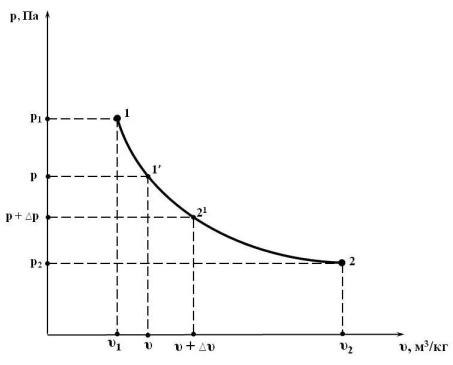
Известно, что равновесный процесс может быть изображён непрерывной кривой, например, в р – υ координатах (рис. 9.1). Это будет р = р (υ) – уравнение процесса, описывающее зависимость абсолютного давления системы р, Па, в ходе процесса, от удельного объёма υ, м3/кг.
Рис. 9.1. Равновесный процесс в р – υ координатах
22
Для некоторой системы, в которой реализуется процесс 1 – 2, первый закон термодинамики (8.1) запишется в виде:
U2 – U1 = Q – L, Дж. |
(9.1) |
На кривой р (υ) выберем произвольную промежуточную точку 1′ с параметрами р и υ. Рассмотрим малую часть процесса 1 – 2 в районе точки 1′, т.е. процесс 1′ → 2′, при котором параметры состояния изменяются на малые величины р и υ.
Для малого процесса 1′ → 2′ запишем первый закон термодинамики в
виде: |
|
|
|
(U + U) – U = |
Q – L, |
|
(9.2) |
где U и U + U – внутренние энергии системы в точках 1′ и 2′ |
соответст- |
||
венно, Дж; U – изменение внутренней |
энергии |
системы в |
процессе |
1′ → 2′, Дж; Q – теплота процесса 1′ → |
2′, Дж; |
L – работа процесса |
|
1′ → 2′, Дж. |
|
|
|
Из (9.2) получаем: |
|
|
|
U = Q – L, |
|
|
(9.3) |
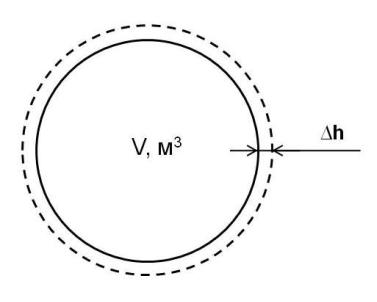
Для определения L схематично изобразим систему в точках 1′ (сплошная линия) и 2′ (пунктирная линия) на рис. 9.2.
Рис. 9.2. Схема процесса 1′ → 2′:
V – объём системы в точке 1′; h – перемещение поверхности системы в процессе
1′ → 2′
23

Исходя из определения механической работы, можем записать:
L |
|
|
|
, |
(9.4) |
F |
h |
где h – среднее перемещение поверхности системы в малом процессе 1′ → 2′, м; F – среднее, за время малого процесса 1′ → 2′, значение силы, действующей на поверхность системы, Н.
В силу малости процесса 1′ → 2′, можем записать: |
|
F F1 F , |
(9.5) |
где F1 – значение силы, действующей на поверхность системы в точке 1′,
Н; F – малое приращение, обусловленное изменениями давления и поверхности системы в ходе процесса 1′ → 2′, Н.
Значение F1 определяется по очевидной формуле, при известных давлении системы р, Па, и площади поверхности системы S, м2, в точке 1′:
|
F p S , Н. |
|
|
|
(9.6) |
||||||
|
1 |
|
|
|
|
|
|
|
|
|
|
Подставляя (9.5) и (9.6) в (9.4) получаем: |
|
|
|
|
|
|
|||||
|
L p S |
|
|
F |
|
. |
(9.7) |
||||
|
h |
h |
|||||||||
В (9.7) перейдём к пределу при р (а значит и |
υ) стремящемся к ну- |
||||||||||
лю: |
|
|
|
|
|
|
|
|
|
|
|
lim |
L = p · S · lim |
|
|
+ lim ( F · |
|
). |
|||||
h |
h |
||||||||||
υ→0 |
υ→0 |
υ→0 |
|
|
|
||||||
|
|
|
|
|
|
p→0 |
|
|
|
||
В результате, отбросив по очевидным причинам бесконечно малые величины второго порядка малости, получаем:
|
|
p dV , |
(9.8) |
||
dL p S dh |
|||||
где dL – дифференциал механической работs процесса 1 – 2, Дж; |
|
|
– |
||
dh |
|||||
дифференциал среднего перемещения поверхности системы в ходе процесса 1 – 2, м; dV – дифференциал изменяющегося в ходе процесса 1 – 2 объё-
ма системы dV S dh , м3.
24

Замечание:
Для наглядности проиллюстрируем справедливость выражения
dV S dh для частного случая, когда система имеет сферический объем:
V |
4 |
πr 3 . |
(9.9) |
|
3 |
|
|
Будем считать, что сфера «раздувается», то есть её радиус изменяется. После дифференцирования (9.9) получаем формулу для бесконечно малого приращения объёма «раздувающейся» сферы:
dV 4πr 2 dr S dr ,
где S – площадь сферы, м2; dr – дифференциал (бесконечно малое приращение) радиуса сферы, м.
Переходя в (9.3) к пределу при р (и υ) стремящихся к нулю и под-
ставляя (9.8) будем иметь: |
|
dU = dQ – dL = dQ – p dV. |
(9.10) |
где dU, dQ и dL – дифференциалы (бесконечно малые приращения) внутренней энергии системы, теплоты и работы процесса соответственно, Дж.
Выражение (9.10) является дифференциальной формой записи первого закона термодинамики.
Разделив обе части (9.10), например, на массу системы, получаем уравнение для удельных величин:
du = dq – dl = dq – p dυ, |
(9.11) |
где dυ – дифференциал удельного объема системы, м3/кг.
Таким образом, удельная механическая работа рассчитывается путём интегрирования дифференциального уравнения вида:
dl = p dυ, |
(9.12) |
где р = p(υ) – уравнение процесса. В примере, изображённом на рис. 9.1. это процесс 1 – 2.
25

После интегрирования (9.12) от начала в точке 1 до конца процесса в точке 2 получаем формулу для расчёта удельной работы любого процесса
1 – 2:
υ2 |
|
l p(υ)dυ. |
(9.13) |
υ1 |
|
где υ1 и υ2 – значения удельного объёма в начале и конце процесса 1 – 2 соответственно, м3/кг.
Из геометрической интерпретации интеграла следует, что значение удельной работы, рассчитываемое по (9.13), равно площади под уравнением процесса р(υ) в р – υ координатах. На рис. 9.1 это площадь под линией процесса 1 – 2.
Для того чтобы по формуле (9.13) вычислить значение удельной работы необходимо знать вид функции р(υ) и пределы интегрирования υ1 и υ2.
10.Понятие теплоемкости
Втермодинамике теплоёмкость веществ определяется для всех агрегатных состояний: твёрдого, жидкого и газообразного. Например, у воды теплоёмкость жидкой фазы примерно в два раза больше, чем газовой – когда вода находится в виде пара.
Строго говоря, под теплоёмкостью термодинамической системы следует понимать её энергоёмкость в процессах, когда энергия к ней подводится в форме теплоты (по механизму теплообмена).
Забегая вперёд, отметим, что теплоёмкости всех веществ, значимых для техники, экспериментально определены и их значения приводятся в справочной литературе. Знание теплоёмкости вещества, главным образом, необходимо для того, чтобы иметь возможность рассчитывать теплоту, которую необходимо подвести к веществу, чтобы нагреть его до определённой температуры или отвести от вещества, при его охлаждении.
Если к некоторому количеству вещества массой М, кг, подвести теплоту в количестве Q, Дж, то его температура возрастет от начальной Т1 до
конечной Т2, К.
Определение:
Отношение T2 Q T1 называется средней теплоёмкостью Сm в дан-
ном процессе в интервале температур от Т1 до Т2:
26
Cm |
|
Q |
, Дж/К. |
(10.1) |
|
T2 |
T1 |
||||
|
|
|
Из опытов известно, что в различных процессах для нагрева одного и того же вещества в одном и том же интервале температур требуется различное количества теплоты. Например, при нагреве газа при постоянном давлении теплоты потребуется больше, чем пи его нагреве при постоянном объёме. Это означает, что теплоёмкость зависит от вида процесса, в котором осуществляется нагрев.
Как будет показано ниже, наибольшее практическое значение имеют теплоёмкости вещества, определяемые в двух процессах: при постоянном удельном объёме υ = const; при постоянном абсолютном давлении
р = const.
Чаще всего в теплотехнических расчётах пользуются удельными массовыми теплоёмкостями.
Формула для определения средней удельной массовой теплоёмкости Сm в диапазоне температур от Т1 до Т2 получается из (10.1) путём деления обоих частей равенства на массу вещества М:
Cm cm |
Q / M |
|
q |
, или cm |
q |
, Дж/(кг · К), (10.2) |
|
T2 T1 |
T2 T1 |
||||
M |
T2 T1 |
|
|
|||
где q – теплота, которую необходимо подвести к 1 кг вещества, чтобы изменить его температуру от Т1 до Т2, Дж/кг.
Примечание:
1)По своему физическому смыслу средняя удельная массовая теплоёмкость – это количество теплоты, которое необходимо подвести к 1 кг вещества, чтобы нагреть его на один градус.
2)Помимо удельных массовых в расчётах используются также удельные объёмные и удельные мольные теплоёмкости (подробнее об этом см. Приложение 5).
Средняя удельная теплоёмкость является свойством конкретного вещества и для данного процесса зависит только от интервала температур
Т= Т1 – Т2, в котором определяется.
Втермодинамике, для удобства расчётов, дополнительно вводится понятие истинной удельной массовой теплоёмкости с, Дж/(кг · К).
27
Отличие в определении истинной теплоёмкости от средней состоит только в том, что истинная определяется по тем же соотношениям (10.1) и (10.2), но при условии, что изменение температуры вещества в ходе процесса стремится к нулю: (Т2 – Т2) = Т → 0. То есть ширина интервала «стягивается» к точке Т1. Следовательно, можно сказать, что истинная теплоёмкость определяется не в интервале температур, а в точке – при одной какой-то температуре. Соответственно и зависеть она будет не от интервала температур как средняя, а просто от температуры – то есть будет является непрерывной функцией температуры, так как при разных температурах, в общем случае, значение истинной теплоёмкости будет разным.
Очевидно, что если в (10.2) знаменатель (Т2 – Т2) = Т стремится к нулю, то и числитель q также будет стремиться к нулю. Из высшей математики известно, что предел такого отношения равен производной от функ-
ции q, зависящей от Т, по переменной Т: |
|
|
|||
lim |
q |
dq |
c , Дж/(кг · К). |
(10.3) |
|
T |
|||||
|
dT |
|
|
||
Т→0
Соотношение (10.3) можно считать определением истинной удель-
ной массовой теплоёмкости, по которому на базе экспериментальных данных определяются её значения.
Соотношение (10.3) можно преобразовать к виду, удобному для расчёта теплоты процесса:
dq = c(T) dT. |
(10.4) |
Если в результате процесса вещество, к примеру, нагревается от Т1 до Т2, то после интегрирования (10.4) в соответствующих пределах получим:
T2 |
|
q c(T )dT , |
(10.5) |
T1 |
|
где q – удельная теплота процесса, Дж/кг.
В термодинамике формулы (10.4) и (10.5) являются основными соотношениями для расчёта удельной теплоты в различных процессах.
Примечание:
С учётом (10.4) первый закон термодинамики (10.11) можно теперь записать в виде:
du = c(T) dT – p(υ) dυ.
28
Очевидно, чтобы воспользоваться соотношением (10.5) необходимо знать функцию с(Т) для данного процесса.
Следует отметить, что, благодаря экспериментам, для всех веществ удельные теплоёмкости при постоянном абсолютном давлении (в дальнейшем для краткости – при постоянном давлении) и при постоянном удельном объёме (в дальнейшем для краткости – при постоянном объёме) известны. Их значения приводятся в справочной литературе в виде таблиц. Зависимость удельной истинной теплоёмкости при постоянном давлении от температуры ср(Т) для всех технически значимых веществ в твёрдой, жидкой и газовой фазах приводится в виде стандартной формулы:
ср(Т) = a1 + a2 · T + a3 · T–2, Дж/(кг · К), |
(10.6) |
где a1, a2 и a3 – известные коэффициенты, имеющие своё значение для каждого вещества; Т – абсолютная температура, К.
10.1.Теплоёмкость газов
Уодного и того же газа значение теплоёмкости, как уже отмечалось, зависит от вида процесса, в котором теплота к газу подводится.
В технике большую роль играют процессы, протекающие в газах при постоянном объёме υ = const и постоянном давлении р = const.
Средние и истинные удельные теплоёмкости газа для этих процессов определяется в соответствии с (10.2) и (10.3) следующим образом:
c pm |
|
|
|
|
q p |
, |
(10.7) |
|||||||
|
T2 |
|
T1 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
c p |
dq p |
|
, |
|
|
(10.8) |
||||||||
|
dT |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
c |
|
|
qυ |
, |
(10.9) |
|||||||||
|
|
|
||||||||||||
υm |
|
|
|
|
T2 |
|
T1 |
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||
c |
|
dqυ |
|
, |
|
|
(10.10) |
|||||||
|
|
|
|
|||||||||||
υ |
|
|
|
|
dT |
|
|
|
|
|
|
|||
где сpm и ср – удельные массовые теплоёмкости газа при постоянном давлении средняя, в интервале температур от Т1 до Т2, и истинная соответствен-
29
но, Дж/(кг · К); qp и dqр – удельные теплота и её дифференциал в процессе нагрева газа при постоянном давлении от Т1 до Т2, Дж/кг; сυm и сυ– удельные массовые теплоёмкости газа при постоянном объёме средняя, в интервале температур от Т1 до Т2, и истинная соответственно, Дж/(кг · К); qυ и dqυ – удельные теплота и её дифференциал в процессе нагрева газа при постоянном объёме от Т1 до Т2, Дж/кг.
Как было отмечено выше, в справочной литературе приводятся таблицы для сpm и формулы типа (10.6) для ср.
Также, благодаря экспериментам, для каждого газа известно значение так называемого показателя адиабаты k, который определяется как отношение удельной теплоёмкости при постоянном давлении к удельной теплоёмкости при постоянном объёме. Например, для одноатомных газов k = 1,67, для двухатомных k = 1,4, а для трёхатомных и многоатомных k = 1,29. Таким образом, зная сpm и ср, а также k, всегда можно вычислить
сυm и сυ.
Замечание:
Строго говоря, удельная теплоёмкость газа зависит от давления, при котором она определялась. Однако существенно эта зависимость проявляется при очень высоких давлениях, которые в обычных теплотехнических расчётах встречаются редко. То есть в большинстве случаев можно приближённо считать, что удельная теплоёмкость не зависит от давления.
В технике часто встречаются процессы, когда в газе одновременно изменяются и давление, и объём.
Соответственно значение теплоёмкости в таком общем случае нам неизвестно. Однако, забегая вперёд, отметим, что в термодинамике разработана теория политропного процесса, которая позволяет рассчитать теплоёмкость для такого рода процессов.
Подробно эта теория будет изложена в соответствующих разделах. Смесь идеальных газов, также как и однородные газы, характеризует-
ся удельной теплоёмкостью, которая рассчитывается по известному химическому составу смеси (подробнее см. Приложение 5).
Примечание:
1) Изменение внутренней энергии любого идеального газа можно вычислить по его истинной удельной теплоёмкости при постоянном объёме сυ(Т). Покажем это.
30
