
ФОТП 2013
.pdf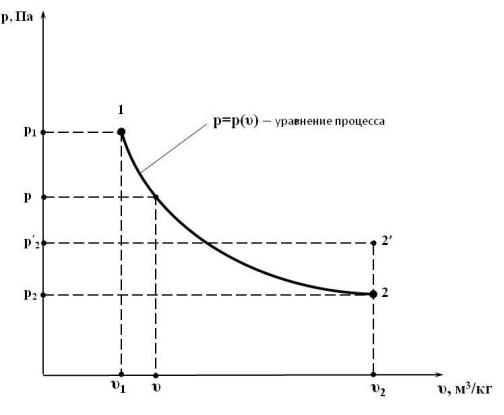
Для анализа равновесные термодинамические процессы удобно представлять в графическом виде, например, в виде графика в р υ-координатах (на р υ-плоскости). В прямоугольных координатах по оси абсцисс откладывается значение удельного объема системы, (например, газа) υ, м3/кг, по оси ординат – абсолютное давление внутри системы р, Па.
В рассматриваемом выше примере (рис. 3.1) начальная точка равновесного состояния 1, определяется путём отложения по осям параметров р1 и υ1, конечная – р2 и υ2, рис. 3.2. В ходе равновесного процесса расширения любое промежуточное состояние системы, по определению, будет также равновесным. То есть любое промежуточное состояние системы, при некоторых р и υ, также может быть отображено на плоскости р υ точкой. Если на р υ плоскости, изобразить все точки промежуточных состояний системы, то они сольются и образуют собой непрерывную линию, которая на-
зывается линией процесса или уравнением процесса. С точки зрения ма-
тематики эта линия иллюстрирует функциональную зависимость абсолютного давления внутри системы р от значения её удельного объема р = р(υ).
Из этого следует, что идеальный равновесный процесс можно изобразить на р υ-плоскости в виде непрерывной линии. (В дальнейшем будет показано, что это справедливо и для других координатных осей).
Рис. 3.2. Графическое представление процессов расширения газа в установке, изображенной на рис. 3.1
11
Касательно неравновесного процесса расширения в пустоту до определенного удельного объема υ2 следует отметить, что всё время процесса система (газ между поршнями) находится в неравновесном состоянии, так как параметры состояния в различных точках объёма имеют разные значения. С течением времени, давление и температура по всему объёму выравняются и система придёт в конечное состояние равновесия – точка 2′ с параметрами p2 и υ2 . При этом, как уже отмечалось, температура, а значит и
давление, в точке 2′ больше, чем в точке 2, что и отражено на рис. 3.2. Таким образом понятно, что неравновесный процесс на р υ-плоскости
в виде линии отображен быть не может. На этой плоскости можно отобразить только его начальное равновесное состояние (точка 1) и конечное равновесное состояние (точка 2′), которое наступит по прошествии некоторого времени после окончания процесса. Это время, за которое система приходит в состояние равновесия, называется временем релаксации.
4.Внутренняя энергия термодинамической системы
Вмеханике вводится понятие работа, которая в системе СИ измеряется в джоулях. Работа – это произведение силы на расстояние, т.е.
1 Дж = 1 Н · 1 м.
По определению энергия – это возможность совершения работы (в
греческом энергия означает деятельность).
Всякая термодинамическая система в любом состоянии обладает запа-
сом внутренней энергии.
Все термодинамические системы состоят из множества элементов (атомов, молекул и т.п.).
Внутренняя энергия системы – это суммарная энергия всех её элементов.
Внутренняя энергия системы экспериментально определяется в такой системе координат, в которой сама термодинамическая система как целое покоится
Пример: Для объема идеального газа, состоящего из молекул - упругих сфер, внутренняя энергия равна сумме кинетических энергий всех молекул газа в системе координат, жестко привязанной к центру масс (ЦМ) этого объема.
Для реального газа к кинетической энергии молекул следует добавить: потенциальную энергию взаимодействия между молекулами; вращатель-
12
ную и колебательную энергию молекул; энергию электронов; энергию ядер и др.
Примечание:
Термодинамический анализ опирается на феноменологический подход. Поэтому при рассмотрении явлений на макроуровне нет необходимости знать микроструктуру внутренней энергии. Например, из опыта известно, что для анализа процессов энергообмена между термодинамической системой и окружающей средой достаточно иметь значения основных параметров состояния системы р, υ и Т. То есть можно говорить, что внутренняя энергия простой системы зависит только от её состояния и, следовательно, однозначно определяется любыми двумя (из трёх) параметров состояния р, υ и Т. (В случае сложных, например, многофазных систем вводится соответствующие дополнительные параметры).
Экспериментально установлено, что внутренняя энергия любой простой термодинамической системы U, Дж, состоит из двух слагаемых. Одно из этих слагаемых является непрерывной функцией двух параметров состояния, например, р и Т. Второе слагаемое не зависит от параметров состояния.
Таким образом, можем записать:
U (р, Т) = Е (р, Т) + const. |
(4.1) |
где U (р, Т) – внутренняя энергия системы, которая является непрерывной функцией двух параметров состояния или, для краткости, просто является функцией состояния, Дж; Е (р, Т) – часть внутренней энергии, которая зависит от параметров состояния, Дж; const – часть внутренней энергии, которая не зависит от параметров состояния (энергия ядер, энергия потенциального взаимодействия между молекулами и др.), Дж.
Неопределенность, которая возникает в (4.1) из-за неизвестной константы (второго слагаемого) представляет собой существенную особенность понятия внутренняя энергия. Но так как на практике всегда рассматривается только изменение энергии в ходе процесса, то есть конечная разность энергий (либо бесконечно малое её изменение – дифференциал), то эта константа не влияет на окончательный результат.
В термодинамике обычно пользуются удельными величинами:
u |
U |
, |
(4.2) |
|
M |
|
|
13
где U – внутренняя энергия системы, Дж; u – удельная внутренняя энергия системы, Дж/кг; М – масса системы, кг.
Удельная внутренняя энергия различных веществ определяется экспериментально и приводится в таблицах справочной литературы, например, как функция р и Т.
5. Энтальпия
Для удобства проведения расчётов в термодинамике помимо внутренней энергии вводится ещё одна функция состояния э н т а л ь п и′ я I (от греческого нагреваю):
I = U + p V, |
(5.1) |
где U – внутренняя энергия системы, Дж; p – абсолютное давление в системе, Па; V – объём, который занимает система, м3.
Разделив обе части (5.1) на массу системы М, кг, получим формулу для удельной энтальпии h:
i |
I |
|
U |
p |
V |
u pυ, |
(5.2) |
|
M |
M |
M |
||||||
|
|
|
|
|
где υ – удельный объем системы (параметр состояния), м3/кг.
Выражение (5.2) можно считать определением удельной энтальпии термодинамической системы.
Из (5.2) очевидно, что h является непрерывной функцией параметров состояния или функцией состояния, так как в правой части оба слагаемые являются непрерывными функциями параметров состояния р и υ. Другими словами, если нам известны значения двух любых параметров состояния, например, р и υ, то этого достаточно, чтобы определить значение i.
Также из (5.2) очевидно, что энтальпия по физическому смыслу является как бы вторичной функцией от внутренней энергии. Значения удельных энтальпий различных веществ определены экспериментально и приводятся в справочных таблицах.
14
6.Эквивалентность теплоты и работы. Историческая справка
Вмеханике работа всегда измерялась как произведение силы на расстояние. В системе СИ работа измеряется в Джоулях:
1 Дж = 1 Н · 1 м.
Энергия материального объекта, по определению, является мерой механической работы, которую этот объект может совершить при определённых условиях. Поэтому размерность энергии и механической работы совпадают. То есть по определению энергия в системе СИ измеряется в Джоулях.
Изначально теплота в физике не считалась энергией и никак с ней не сопоставлялась. Считалось, что теплота проявляется при изменении температуры тел. Количественное измерение теплоты стало возможно после изобретении первого термометра (около 1590 года), позволявшего измерять температуру тел в градусах. Изменение температуры тел объясняли «впитыванием» этими телами флюидов теплорода – невесомой жидкости, подобно тому, как вода впитывается губкой.
Исторически теплота измерялась в калориях (от латинского calor – тепло). Одна калория определялась как количество теплорода, которое необходимо передать воде для повышения температуры одного грамма воды на один градус.
Физики всегда отмечали, что между Джоулями и калориями существует какая-то связь. Например, когда молот бьёт по наковальне, то кинетическая энергия молота, измеряемая в Джоулях, исчезает, но зато увеличивается температура и молота, и наковальни. Такое повышение температуры, в те времена объяснялось поступлением к этим объектам т е п л о р о - д а из окружающей среды. Аналогичным образом дело обстояло при совершении механической работы против сил трения.
Постепенно в физике был поставлен вопрос об экспериментальном определении количественных соотношений между калориями и Джоулями в различных процессах.
Первые исследователи этого вопроса были несколько удивлены, когда выяснилось, что в отличающихся процессах при «превращении» Джоулей
вкалории пропорция между ними примерно сохраняется.
В1844 – 1854 гг. английский физик Д.Джоуль провёл опыты, которым было суждено сыграть большую роль в науке. Цель опытов состояла в том, чтобы установить соотношение между работой, затрачиваемой при выделении теплоты, и количеством выделившейся теплоты. Схема опыта Джоуля приведена на рис. 6.1.
15

Рис. 6.1. Схема опыта Джоуля: 1 – сосуд; 2 – мешалка; 3 лопатки
В теплоизолированный медный сосуд 1, заполненный водой, погружена мешалка 2, снабжённая лопатками. К стенкам сосуда также прикреплены лопатки 3, затрудняющие движение воды при вращении мешалки. Мешалка приводится во вращение посредством опускания связанного с ней тросом через блок 5 груза 4 массой М, кг. Благодаря механической передаче скорость вращения лопаток мешалки составляет порядка 700 мин –1 [2]. При опускании на высоту h работа L, Дж, производимая грузом и, следовательно, мешалкой, равняется убыли потенциальной энергии груза:
L = M · g · h, Дж,
где g – ускорение свободного падения, м/с2.
Теплота Q, выделившаяся в сосуде с водой вычисляется в калориях по повышению температуры воды, измеряемой термометром. Масса воды была заранее измерена. Учитывалось поглощение теплоты стенками сосуда, лопатками и мешалкой. Усредняя данные своих экспериментов Джоуль приходит у выводу: «Для получения количества тепла, которое в состоянии нагреть один фунт воды на один градус Фарингейта, необходимо упо-
16
требить механическую силу, которая может быть представлена падением 772 фунтов с высоты в один фут». Из этих данных следует, что найденный Джоулем механический эквивалент калории Jдж равен [3]:
J дж |
L |
4,24 , Дж/кал. |
(6.1) |
|
Q |
||||
|
|
|
Впоследствии производились многочисленные эксперименты определения этой «универсальной постоянной», как её называл Гельмгольц. Например, опыты Г.Грина, который, исследуя в 1860 – 1861 гг. соударения двух свинцовых тел, нашел значение эквивалента равным 4,166 Дж/кал. А также опыты Роуланда (1880 г.) который методом Джоуля получил значение эквивалента 4,186 Дж/кал, что считается достаточно точным и по настоящее время.
Впоследствии значение эквивалента, полученного Джоулем, было несколько уточнено. В соответствии с результатами наиболее точных современных измерений [4] механический эквивалент теплоты J равен:
J |
L |
4,1868 Дж/кал. |
(6.2) |
|
Q |
||||
|
|
|
Другими словами:
1 кал = 4,1868 Дж. |
(6.3) |
Определяемая (6.3) калория называется Международной. Её значение установлено в 1948 году на IX Генеральной конференции по мерам и весам как точное равенство [2].
Теплоёмкость воды несколько зависит от температуры. Международная калория определяется как количество теплоты, расходуемой на нагревание 1 грамма воды при нормальном атмосферном давлении от 14,5 до 15,5 С. Иногда её называют 15-градусная калория.
Если нагрев на один градус производится при исходной температуре воды, соответствующей нормальным условиям (нормальному давлению
ро = 760 мм рт. ст. = 101325 Па и нормальной температуре to = 0 С), то такая калория называется термохимической:
1 кал (термохимическая) = 4,14 Дж.
17
Установленная таким образом однозначная для всех процессов связь между Джоулями и калориями впервые позволила аналитически сформулировать закон сохранения энергии, который был назван «Первое начало термодинамики».
7. Особенности процессов передачи энергии в форме теплоты и работы
Как следует из сказанного выше и работа, и теплота являются количеством энергии, которое один материальный объект передаёт другому в некотором термодинамическом процессе.
Если термодинамического процесса не происходит, то по определению, термодинамическая система находится в состоянии равновесия и ни о теплоте, ни о работе говорить не приходится.
Если некоторый термодинамический процесс происходит, то в общем случае, энергия в ходе процесса может передаваться от одного материального объекта другому по двум различным механизмам: в форме теплоты
и в форме механической работы.
Примечание:
Теплота и работа являются неравноценными формами передачи энергии.
Они неравноценны прежде всего потому, что работа может быть непосредственно направлена на пополнение запаса любого вида энергии. Например: потенциальной энергии в поле силы тяготения; электрической и магнитной энергии; внутренней энергии и др.
Теплота же непосредственно, то есть без промежуточного преобразования в работу, может быть направлена на пополнение запаса только внутренней энергии тел.
Отличительные признаки теплоты и работы можно проиллюстрировать на следующем примере. Рассмотрим установку на рис. 7.1, в которой газ находится в канале 1 между двумя подвижными поршнями 2.
Также установка содержит две пружины 3 и электронагреватель 4. Пружины 3 прикреплены к поршням 2 и стенкам канала 1 таким обра-
зом, что давление, которое газ оказывает на поршни 2, уравновешивается силами, действующими на них со стороны пружин 3.
Эксперимент состоит в подводе к газу некоторого количества энергии в форме теплоты с помощью электронагревателя 4.
18
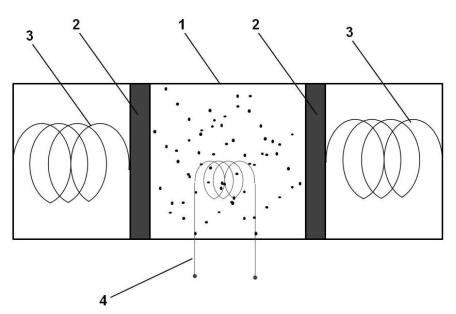
В результате подвода теплоты газ расширяется. Его температура возрастает. Пружины 3 сжимаются. Их потенциальная энергия возрастает.
Рис. 7.1. Экспериментальная установка
Вэтом процессе обмениваются энергией следующие материальные объекты: электронагреватель 4 и молекулы газа; молекулы газа и поршни 2, во врем их перемещения из начального положения в конечное; поршни 2, во время их перемещения, и пружины 3.
Для наглядности будем считать поршни невесомыми. Так что их энергия в ходе процесса не изменяется.
Вэтом случае поршни 2 являются передаточным звеном при передаче энергии от молекул газа пружинам 3. Эта передача энергии связана с расширением газа и совершением механической работы по сжатию пружин. То есть энергия от термодинамической системы при её расширении отводится от неё в форме механической работы, которая затрачивается на сжатие пружин 3 – на увеличение их потенциальной энергии.
Электронагреватель 4, который также можно рассматривать как термодинамическую систему, передавая энергию молекул газа, своих границ не расширяет и, соответственно, никакой механической работы не производит (если перемещение равно нулю, то и механическая работа, по определению, будет равна нулю). Такой механизм передачи энергии, называют теплообменом. Энергия в подобных случаях передаётся в форме теплоты или по механизму теплообмена. (Всего существует, как известно, три механизма теплообмена: теплопроводность, конвекция и излучение).
19
Приведённый пример позволяет сделать следующие выводы.
Отличительным признаком передачи энергии в форме механической работы является то, что такой обмен энергии происходит при обязательном смещении границ системы, например, при её расширении или сжатии.
Отличительный признак передачи энергии в форме теплоты состоит в том, что такой обмен энергией системы с окружающей средой может происходить без смещения границ системы, то есть без изменения её объёма.
8. Первый закон термодинамики для замкнутой термодинамической системы
Первый закон термодинамики установлен экспериментально, то есть является обобщением опытных данных, которые получены путём наблюдений за различными термодинамическими процессами – равновесными и неравновесными. Например, таким процессом является расширение газа, рассмотренное в п. 7, где газ, заключённый между поршнями, рассматривается как замкнутая термодинамическая система.
Первый закон термодинамики можно сформулировать следующим образом.
Пусть замкнутая термодинамическая система находится в начальном состоянии равновесия 1. При этом параметры состояния системы и её внутренняя энергия имеют значения р1, υ1, Т1 и U1. Затем в системе происходит некоторый процесс, после чего система приходит в новее – конечное состояние равновесия 2, в котором параметры системы и её внутренняя энергия имеют значения р2, υ2, Т2 и U2. Изменение внутренней энергии системы, происходящее в результате такого процесса, равно разности между количеством энергии, подведённым к системе в форме теплоты, и количеством энергии, отведённым от неё в форме работы:
U2 – U1 = Q – L, |
(8.1) |
где U2 – U1 – изменение энергии системы в результате процесса, Дж; Q – энергия, подводимая к системе в форме теплоты, Дж; L – энергия, отведённая от системы в форме работы, Дж.
Выражение (8.1) является аналитической формой записи первого закона термодинамики. По сути оно говорит о том, что изменение энергии системы во время процесса равно количеству энергии, которое система по-
20
