
- •С.С. Виноградов
- •Экологически безопасное гальваническое производство
- •Под редакцией проф. В.Н.Кудрявцева
- •Раздел 1. Экологическая опасность технологических растворов 7 гальванического производства и направления ее снижения
- •Раздел 4. Базовые принципиальные схемы очистки промывных и 162 сточных вод
- •Раздел 6. Регенерация (восстановление работоспособности) 241 отработанных электролитов
- •Раздел 8. Утилизация гальванических шламов 289
- •Раздел 9. Создание экологически безопасного гальванического 297 производства
- •Раздел 1. Экологическая опасность технологических растворов гальванического производства и направления ее снижения
- •1.3. Базовые составы растворов и электролитов
- •Анодное окисление алюминия и его сплавов
- •Химическое оксидирование алюминия и его сплавов
- •Покрытий
- •Раздел 2. Рациональное водопотребление на промывочных операциях
- •Удельные нормы расхода воды в зависимости от количества ступеней
- •Раздел 3. Состав и объём сточных вод гальванического производства
- •Процессов
- •Iimpomaiii
- •3.2. Состав и объём общих сточных вод от цеха (участка) гальванопокрытий
- •Раздел 4. Базовые принципиальные схемы очистки промывных и сточных вод
- •Содержание активной части и условия поставки
- •4.2. Электрокоагуляционный метод
- •Ионообменная очистка
- •Метод электрофлотации
- •4.6. Метод электродиализа
- •Поверхностный спои адсорбированных молекул воды
- •1 Вода 1 на доочистку
- •4.10. Метод жидкостной экстракции
- •Метод дозированного выпаривания
- •Раздел 5. Принципы адаптации гальванического цеха и систем очистки сточных вод
- •Раздел 6. Регенерация (восстановление работоспособности) отработанных электролитов
- •6.1. Классификация методов обработки отработанных растворов и
- •6.2. Регенерация отработанных растворов и электролитов
- •Регенерация растворов обезжиривания
- •Ihuh Очищенный раствор Рис. 6.1. Схема мембранной очистки обезжиривающих растворов
- •6.2.2. Регенерация травильных растворов
- •6.2.4. Регенерация электролитов кадмирования
- •6.2.7. Регенерация хромсодержащих растворов и электролитов
- •Раздел 7. Рекуперация (утилизация в гальваническом производстве) отработанных технологических растворов
- •Рекуперация (утилизация в гальваническом производстве)
- •Отработанных технологических растворов, содержащих шестивалентный хром
- •Раздел 8. Утилизация гальванических шламов
- •Раздел 9. Создание экологически безопасного гальванического производства
- •Химикаты вода
Электрокоагуляция
как метод превращения примесей в
грубодисперсное состояние основывается
на множестве физикохимических
процессов, протекающих в жидкости под
воздействием электрического тока:
электростатическая
(поляризационная) коагуляция - диполь-
дипольное взаимодействие коллоидных
частиц за счет дальнодействующих сил
притяжения, возникающих при наложении
электрического поля;
электрохимическая
коагуляция - взаимодействие частиц
при изменении их заряда или толщины
двойного электрического слоя за счет
изменения физико-химических свойств
раствора (pH и Eh)
в межэлектродном объёме или приэлектродных
слоях;
электролитическая
коагуляция - взаимодействие частиц
при введении потенциалообразующих
ионов металлов за счет электрохимического
растворения электродов;
гидродинамическая
коагуляция - слипание частиц за счет
увеличения числа их столкновений при
перемешивании жидкости в электролизере
(перемешивание жидкости может
осуществляться как продуктами
электрохимических реакций, так и за
счет конструктивных приемов);
концентрационная
коагуляция - увеличение числа столкновений
частиц, приводящих к их слипанию, за
счет повышения локальных концентраций
частиц в межэлектродном объёме при их
транспорте, осаждении на электродах и
т.п.
Электрокоагуляционный
метод применяют в основном для очистки
хромсодержащих сточных вод.
В
результате электролитического
растворения стальных анодов при рН>2
образуются ионы Fe2+
по следующей схеме:
Fe
+ ОН- <-» FeOH+
(аде) + е-;
РеОН+(адс)+
ОН- <-» Ре(ОН)2(адс);
Ре(ОН)2(адо
^ Fe(OH)2(now);
Fe(OH)2(»oW)
<-> FeOH+
+ ОН-;
FeOH+
<-> Fe2+
+ ОН-.
4.2. Электрокоагуляционный метод
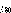
В
настоящее время существуют две основные
концепции теоретического обоснования
механизма коагуляции, обусловленной
введением положительных многозарядных
ионов железа, гидролизующихся в воде
с образованием гидроксидов и других
промежуточных соединений:
специфическая
сорбция многозарядных ионов (Al3+,
Fe3+,
Fe2+
и др.) на частицы с последующим изменением
заряда её поверхности, что приводит к
коагуляции;
образование
малорастворимых соединений ионов
металла с компонентами раствора, которые
взаимодействуют с коллоидными частицами,
имеющими противоположный заряд
поверхности.
Необходимо
отметить, что обе концепции теоретически
и экспериментально недостаточно
обоснованы. Однако многочисленными
экспериментами доказано, что скорость
коагуляции значительно выше при
формировании малорастворимых соединений.
Можно предположить преимущественное
влияние адгезионного механизма
взаимодействия противоположно заряженных
поверхностей частиц и гидроксидов.
Исходя из этого процесс электрокоагуляции
можно разделить на следующие стадии:
генерация ионов металла на поверхности
электрода; миграция ионов металла с
поверхности в объём раствора; образование
малорастворимых соединений металла с
компонентами раствора; адгезия коллоидных
частиц примесей и образовавшихся
малорастворимых соединений.
Одновременно
этими процессами ионы Fe2+,
а также гидроксид железа (II), способствуют
химическому восстановлению Сг6+
до Сг3+
по реакциям:
при
рН< 5,5 Сг2072-
+ 6Fe2+
+ 14Н+
-> 6Fe3+
+ 2Сг3+
+ 7ШО
при
рНй 5,5 Cr2072
+3Fe(0H)2+4H20^3Fe(0H)3+2Cr(0H)3+20H
. Некоторое количество СгОд2-
и Сгг072-
-ионов восстанавливается до ионов Сг3+
в результате катодных электрохимических
процессов:
катод
СГ2О72-
+ 14Н+ + 6е- 2Сг3+
+ 7НгО
Сг2От2-
+ 4Н20
+ Зе- -> 2Сг(ОН)з + 50Н-
При
электрохимической обработке сточных
вод происходи! их подщелачивание, что
способствует коагуляции гидроксидоЕ
железа (II) и (III) и хрома (III), а также
гидроксидов других тяжелых металлов,
ионы которых могут содержаться в сточных
водах
181
|
Концентрация Сг (VI), мг/л |
При наличии Zn2+, Cu2+ |
При наличии Ni2+, Cd2+ |
|
менее 20 |
6-7 |
6-7 |
|
20-50 |
5-6 |
6-7 |
|
50-150 |
4-6 |
5-6 |
Содержащиеся
в сточных водах ионы N02%
N03',
СОз2-,
РО43
при проведении процесса электролиза
вызывают пассивацию поверхности анодов.
Для активации анодов добавляют хлорид
натрия, при этом рекомендуется
поддерживать в стоке соотношения
анионов, указанные в табл.4.5. Ультразвуковая
очистка электродов, вибрация, встряхивание,
высокая скорость движения воды в
межэлектродном пространстве при
напорном режиме или за счет рециркуляции,
однопоточная схема движения воды,
механическая чистка электродов
скребками, продувка межэлектродного
пространства газом, вращающийся
растворимый электрод и другие меры
снижают опасность пассивации анодов.
182
|
Концентрация Сг (VI), мг/л |
При отсутствии пассиви-рующих анионов |
При наличии в стоке пассивирующих анионов |
|
менее 100 |
С1-: Сг6+ = 1:4 (SC>42- + С1) : Сг«+ = 1:1 |
SOl'+CV 16 |
|
NO" + NO’ + СО*" + РО3- “ 1 | ||
|
более 100 |
С1:Сг«+ = 1:1 |
|
Полнота
восстановления Сг6+
до Сг3+
и продолжительность обработки стоков
зависит от интенсивности растворения
железных анодов, которая в свою очередь
определяется количеством пропущенного
электричества. Теоретический расход
электричества на восстановление 1 г
Сг6+
составляет:
0,96
х 3,22 = 3,08 (Ач) где 0,96 - количество
электричества, затрачиваемое на
растворение 1 г металлического железа,
А ч;
3,22
- количество Fe2+
в граммах, необходимое для восстановления
1 г Сг6+
в соответствии с уравнением реакции.
Теоретические
расходы железа и электричества для
обработки 1 м3
стачных вод с различной концентрацией
Сг6+
можно определить по таол.4.6.
Таблица
4.6
Теоретические
расходы железа и электричества трация Сг«+, г/м3 |
Теоретический расход железа, г/м3 |
Теоретический расход электричества, А-ч/м3 |
Концен трация Сг6+, г/м3 |
Теоретичес кий расход железа г/м3 |
Теоретический расход электричества, А-ч/м3 |
|
1 |
3,22 |
3,08 |
10 |
32,2 |
30,8 |
|
2 |
6,44 |
6,16 |
20 |
64,4 |
61,6 |
|
3 |
9,66 |
9,24 |
30 |
96,6 |
92,4 |
|
4 |
12,88 |
12,32 |
40 |
128,8 |
123,2 |
|
5 |
16,10 |
15,40 |
50 |
161,0 |
154,0 |
|
6 |
19,32 |
18,48 |
60 |
193,2 |
184,8 |
|
7 |
22,54 |
21.56 |
70 |
225,4 |
215,6 |
|
8 |
25,76 |
24,64 |
80 |
257,6 |
246,4 |
|
9 |
28,98 |
27,72 |
90 |
289,8 |
277,2 |
|
10 |
32,20 |
30,80 |
100 |
322,0 |
308,0 |
183
|
Металл |
Расход железа, г/г удаляемого металла |
Теоретический расход электричества, А-ч/г удаляемого металла |
|
Цинк (Zn2+) |
2,5-3,0 |
2,30-2,88 |
|
Медь(Си2+) |
3,0-3,5 |
2,88-3,36 |
|
Кадмий (Cd2+) |
4,0-4,5 |
3,84-4,32 |
|
Никель (Ni2+) |
5,5-6,0 |
5,30-5,75 |
Электрокоагулятор
включает в себя две секции: пластинчатый
электролизер вертикального исполнения
с подводом очищаемой воды снизу вверх
и осветлитель.
Электролиз
проводят при следующих параметрах:
плотность тока на аноде 0,6-1,5 А/дм2
для концентрированных вод и 0,15-0,8 А/дм2
для разбавленных (>100 мг/л) стоков,
напряжение на
184
электродах
12-24 В (при солесодержании менее 500 мг/л),
6-12 В (при солесодержании более 500 мг/л);
продолжительность обработки 60 - 180 с;
материал электродов - низкоуглеродистая
сталь (Ст.З, Ст.4 и др.); толщина электродов
3-8 мм; расстояние между электродами 6-
12 мм. Процесс электрокоагуляции может
быть значительно интенсифицирован при
повышении температуры обрабатываемой
воды до 60-80 °С и анодной плотности тока
2-2,5 А/дм2.
При этом твердая фаза гидроксидов
меняет свою структуру и приобретает
ферромагнитные свойства. При
электрокоагуляции фторсодержащих
сточных вод применяют алюминиевые
электроды. В последние годы предложено
несколько конструкций электролизеров
с засыпными анодами из отходов
металлообработки.
В
качестве осветлителя используют
отстойники, флотаторы- отстойники,
флотаторы-осветлители. Так как в
электродной секции происходит усиленное
насыщение воды пузырьками выделяющегося
водорода, то в осветлителе часть
скоагулированной твердой фазы всплывает
на поверхность воды, а часть оседает
на дно. Для уменьшения объёма осадка и
ускорения процесса осветления в
обрабатываемую воду добавляют раствор
полиакриламида в количестве 30 мг/л.
Рис.4.3.
Принципиальная схема электрокоагуляционной
очистки:
1-накопитель
хромсодержащих стоков, 2-иасос,
3-электрокоагулятор, 4-выпрямитель,
5-дозатор раствора хлорида натрия
185
При
соблюдении указанных условий и исходной
концентрации каждого из ионов тяжелых
металлов, не превышающей 30 мг/л, степень
очистки от них сточных вод составляет
90-95%. После 24-часового уплотнения объем
осадка уменьшается на 20-30%, влажность
его при этом достигает 98,2- 98,5%.
При
необходимости осуществляют доочистку
от ионов тяжелых металлов обработкой
щелочными реагентами (см. п.4.1.1 - метод
нейтрализации) с последующей фильтрацией
на песчаных и пенополистирольных
фильтрах.
Гальванокоагуляционнын
метод
В
основе принципа гальванокоагуляции
лежат те же физикохимические процессы,
которые составляют сущность
электрокоагуляции. Отличие данного
метода от электрокоагуляции заключается
в способе введения в обрабатываемый
сток ионов железа, а также в отсутствии
электростатической (поляризационной)
коагуляции, возникающей при наложении
электрического поля.
При
гальванокоагуляционной очистке
очищаемую воду пропускают через железные
стружки, смешанные с коксом в соотношении
4 : 1 или с медной стружкой в соотношении
2,5 : 1. В результате контакта железо-кокс
или железо-медь образуется гальванопара,
в которой железо является анодом. За
счет разности электрохимических
потенциалов железо переходит в раствор
без наложения тока от внешнего источника:
ре
_ 2е лимингс...^ Fe2+.
В
качестве катодных реакций могут
протекать реакции выделения водорода,
контактного осаждения более благородных,
чем железо, металлов и др.
Процесс
гальванокоагуляции проводят в проточных
вращающихся аппаратах барабанного
типа. При вращении барабана стружечная
загрузка попеременно то погружается
в протекающий сквозь него сток, то
оказывается на воздухе, е
результате
обеспечивается окисление кислородом
воздуха двухвалентного железа до
трехвалентного по реакциям:
186
4Fe2+
+ O2
+ 2НгО —> 4Fe3+
+ 40H-,
Fe3+
+ ЗН2О
-► Fe(OH)3
+ 3H+,
или
суммарно
4Fe2+
+ O2
+ IOH2O
—> 4Fe(OH)3
+ 8H+.
В
процессе осаждения гидроксида железа
(III) происходит уплотнение осадка
амфотерного Fe(OH)3
в гематит се- РегОз:
2Fe(OH)3
-> Fe203
+ 3H20.
В
свою очередь соединения железа (III) при
контакте с железной стружкой
восстанавливается до соединений железа
(II), например:
2FeCb
+ Fe
-> 3FeC!2.
Таким
образом, в обрабатываемой сточной воде
образуются соединения
железа
(II) и (III), причем соединения железа (II)
способствуют восстановлению хрома
(VI) до хрома (III) по реакциям:
СГ2О72-
+ 6Fe2+
+14Н+
-» 6Fe3+
+ 2Сг3+
+ 7НгО
Сг2От2-
+ 3Fe(OH)2
+4Н20
-> Сг(ОН)з I
+
3Fe(OH)31
+ 20Н-, а соединения железа (III) в виде
гидроксидных соединений трехвалентного
железа (лепидокрокита и гетита) и
оксидных (магнетита Fe304
и гематита Ре2Оз)
участвуют в сорбции и коагуляции
загрязнений а также в процессах
ферритообразования.
Вращение
барабана обеспечивает постоянное
обновление поверхности железной стружки
за счет трения.
На
рис.4.4 представлена принципиальная
схема гальванокоагуляционной очистки.
Очистка
сточных вод обеспечивается одновременным
действием нескольких механизмов,
основными из которых являются:
восстановление
шестивалентного хрома до трехвалентного;
контактное
осаждение металлов на поверхности
железной стружки;
коагуляция
грубодисперсных примесей;
образование
соединений включения (клатратов);
образование
ферритов;
сорбция
органических веществ на свежеобразовавшихся
кристаллообразных соединениях железа.
Тяжелые
цветные металлы извлекаются в виде
ферритов. Наиболее эффективное извлечение
меди, цинка, хрома (VI) и хрома (III) из
сернокислых растворов наблюдается при
pH исходных стоков 2,5-2,7, причем медь и
хром (III) эффективно извлекаются в
широком диапазоне исходных концентраций
от 50 до 250 мг/л; хром (VI) - до 200 мг/л. Никель
наиболее эффективно извлекается при
pH
5-3,7,
Цинк и никель хорошо извлекаются лишь
при низких концентрациях: до 50 мг/л -
цинк и до 100 мг/л - никель. Конечная
концентрация ионов тяжелых металлов
- 1,0 - 0,1 мг/л.
Сульфат-ион
извлекается в виде сложного
сульфооксигидроксокомплекса железа
и в незначительных количествах в виде
сульфата железа. Небольшая часть
сульфат- ионов извлекается за счет
восстановления S6+
в определенных условиях до S2-
и выделения в виде малорастворимого
сульфида железа (пирротина).
Кальций
извлекается примерно на 50 % за счет
формирования микрокристаллов CaSC>4
в адсорбционных слоях коллоидных мицелл
оксигидроксокомплексов железа, а также
в виде сложного алюмосиликата -
плагиоклаза (Na,
Са) AlSisOe
(при использовании в качестве загрузки
вместо железной алюминиевой стружки
в смеси с коксом).
хромовые
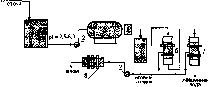
Рис.
4.4. Принципиальная схема гальванокоагуляциоиной
очистки:
1
-накопитель хромовых стоков, 2-насос,
3-гальванокоагулятор, 4-ловитель скрапа,
5-отстойиик, 6-механический фильтр,
7-фильтр с плавающей загрузкой,
8-пресс-фильтр.
188
При гальванокоагуляционной очистке расход железа составляет 0,2-1,0 кг на 1 м3 очищаемых стоков в зависимости от pH обрабатываемой воды. В результате очистки образуется 0,4-1,5 кг железистого отхода на 1 м3 очищаемых сточных вод.
Для глубокой очистки сточных вод гальванокоагуляционный метод применяют в сочетании с последующей обработкой стоков известковым молоком. Кроме того, сточная вода, прошедшая обработку в гальванокоагуляторе, содержит большое количество взвешенных, плохо отстаивающихся мелкодисперсных твердых частиц, представляющих собой главным образом ферриты и частички кокса. Поэтому стоки перед сбросом в канализацию подвергают многоступенчатой очистке от взвешенных частиц: отстаивание в отстойнике, фильтрование через пористые материалы и фильтры с плавающей загрузкой. Осадок из нижней части отстойника подвергают фильтрованию на пресс-фильтрах.
