
- •Введение
- •Признаки объектов коллоидной химии
- •Геометрические параметры поверхности
- •Классификация дисперсных систем
- •1. Классификация дисперсных систем в зависимости от размера коллоидных частиц
- •3. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- •5. Классификация по степени взаимодействия частиц ДФ
- •6. классификации дисперсных систем по характеру распределения фаз, образованных дисперсными частицами и дисперсионной средой
- •7. Суспензоиды и молекулярные коллоиды
- •Классификация поверхностных явлений
- •Поверхностная энергия Гиббса. Поверхностное натяжение
- •Методы определения поверхностного натяжения
- •Метод капиллярного поднятия
- •Метод максимального давления пузырьков
- •Метод счета капель (сталагмометрический)
- •Метод отрыва кольца
- •Внутренняя (полная) удельная поверхностная энергия. Зависимость энергетических параметров поверхности от температуры
- •Теории адгезии
- •Смачивание и краевой угол
- •Связь работы адгезии с краевым углом
- •Инверсия смачивания
- •Смачивание реальных твердых тел
- •Теплота смачивания
- •Растекание жидкости. Эффект Марангони
- •Фундаментальное адсорбционное уравнение Гиббса. Гиббсовская адсорбция
- •Поверхностная активность. Поверхностно-активные и инактивные вещества
- •Энергетические параметры адсорбции
- •Адсорбционные взаимодействия
- •Закон Генри
- •Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •Уравнение Фрёйндлиха
- •Зависимость поверхностного натяжения от концентрации ПАВ
- •Строение адсорбционного слоя на границе раствор—газ
- •Адсорбция на границе твердое тело — раствор
- •Влияние природы среды
- •Влияние свойств адсорбента и адсорбтива
- •Влияние времени, температуры и концентрации раствора
- •Полимолекулярная (потенциальная) теория адсорбции Поляни
- •Теория полимолекулярной адсорбции БЭТ
- •Типы изотерм адсорбции
- •Капиллярные явления
- •Адсорбция газов и паров на пористых телах
- •Классификация пористой структуры
- •Количественные характеристики пористых тел и порошков
- •Теория капиллярной конденсации. Распределение пор по размерам
- •Теория объемного заполнения микропор
- •Ионная адсорбция
- •Образование и строение, двойного электрического слоя
- •Механизм образования двойного электрического слоя
- •Теория Гельмгольца — Перрена
- •Теория Гуи — Чэпмена
- •Теория Штерна
- •Формула мицеллы
- •Влияние различных факторов на электорокинетический потенциал
- •Влияние индифферентных электролитов
- •Влияние неиндифферентных электролитов
- •Влияние рН среды
- •Влияние концентрации коллоидной системы
- •Влияние температуры
- •Влияние природы дисперсионной среды
- •Электрокинетические явления
- •Практическое значение электрокинетических явлений
- •Молекулярно-кинетические и реологические свойства дисперсных систем
- •Броуновское движение и диффузия в коллоидных системах
- •Седиментация и седиментационная устойчивость
- •Закономерности седиментации в гравитационном поле.
- •Седиментация в центробежном поле
- •Седиментационный анализ
- •Вязкость дисперсных систем
- •Агрегативная устойчивость и коагуляция дисперсных систем
- •Процессы в дисперсных системах, обусловленные агрегативной неустойчивостью
- •Факторы агрегативной устойчивости
- •Теории коагуляции электролитами
- •Теория ДЛФО
- •Правила коагуляции
- •Особые явления, наблюдающиеся при коагуляции электролитами
- •Явление неправильных рядов
- •Антагонизм и синергизм электролитов
- •Привыкание коллоидных систем
- •Защита коллоидных частиц и сенсибилизация
- •Кинетика коагуляции
- •Строение мицелл ПАВ. Солюбилизация
- •Свойства растворов высокомолекулярных соединений (молекулярных коллоидов)
- •Общая характеристика высокомолекулярных соединений
- •Набухание и растворение высокомолекулярных соединений
- •Виды набухания полимеров
- •Кинетика набухания полимеров
- •Оптические свойства и методы исследования дисперсных систем
- •Рассеяние света
- •Абсорбция света
- •Окраска коллоидных систем
- •Форма частиц и двойное лучепреломление в потоке (Оптическая анизотропия)
- •Световая и электронная микроскопия
- •Ультрамикроскопия
- •Турбидиметрия
- •Нефелометрия
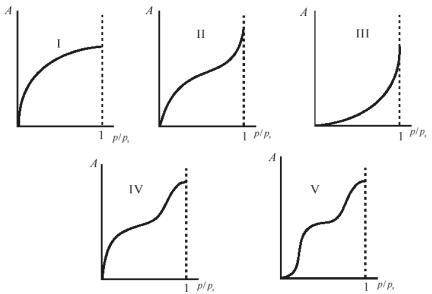
Типы изотерм адсорбции
Рисунок 17 – Основные типы изотерм адсорбции
Изотермы типа I отражают мономолекулярную адсорбцию. Изотермы типа II и III обычно связывают с образованием при адсорбции многих слоев, т.е. с полимолекулярной адсорбцией. Причем, в случае (II) взаимодействие адсорбент - адсорбат сильнее взаимодействия адсорбат - адсорбат, а в случае (III) - наоборот. Изотермы типа IV и V отличаются тем, что для них характерна конечная адсорбция при приближении давления пара к давлению насыщения ps. Изотермы типа II и III характерны для адсорбции на непористом адсорбенте, а типа IV и V - на пористом твердом теле. Все пять типов изотерм адсорбции описываются теорией полимолекулярной адсорбции “БЭТ”.
Капиллярные явления
Предположим, что мы опустили капилляр в некую жидкость. В зависимости от природы жидкости и материала капилляра возможны два варианта: жидкость смачивает капилляр, и жидкость не смачивает капилляр. В первом случае мы будем наблюдать самопроизвольное поднятие уровня жидкости по капилляру на некоторую величину. Это обусловлено тем, что поверхностно натяжение на границе ТГ больше, чем геометрическая сумма сил, обусловленная
действием поверхностного натяжения на границах ТЖ и ЖГ: ТГ результате система, проявляя тенденцию к снижению общей ее энергии, стремится к уменьшению
ТГ путем покрытия как можно большей площади твердого тела жидкостью (при этом площадь границы ТГ уменьшается и соответственно уменьшается энергия Гиббса, равная S). Иными словами, сила взаимодействия жидкости с материалом капилляра преобладает над суммарной силой взаимодействия жидкости с газом и газа с материалом капилляра.
|
В |
противоположном |
случае, |
когда |
имеет |
место |
обратное |
неравенство |
ТГ |
ТЖ ЖГ cos , уровень жидкости в капилляре становится ниже уровня жидкости в |
|||||||
сосуде. |
|
|
|
|
|
|
|
|
В результате описанных процессов мы будем наблюдать либо вогнутый, либо выпуклый (не плоский!) мениск жидкости в капилляре, т. е. форма межфазной поверхности на границе ЖГ будет искривлена (в данном случае она будет сферической).
Искривление межфазной поверхности наблюдается практически для любых систем на микроуровне. Идеально плоская поверхность наблюдается в редких случаях и является скорее исключением. Однако сильно выраженное искривление характерно именно для высокодисперсных систем, т. е. для мелких частиц – частиц дисперсной фазы золей, суспензий, эмульсий, нитей, капелек жидкости в газе и т. п.
Представим себе какую-нибудь систему, в которой имеется искривленная поверхность. Для наглядности возьмем мыльный пузырь, выдуваемый через трубочку. Если, выдув пузырь, оставить трубочку открытой, пузырь тут же сдуется. Это свидетельствует о том, что давление с
внешней стороны пузыря превышает давление внутри пузыря. Иными словами, в состоянии равновесия давления в фазах, разделенных искривленной поверхностью, различаются. Эта разность давлений называют капиллярным давлением.
В большинстве случаев мы имеем дело с фазами, находящимися в равновесии с атмосферой. В этом случае давление воздуха можно рассматривать как постоянное, а капиллярное давление – как избыточное давление в конденсированной фазе, которое создается за счет искривления поверхности раздела фаз.
Количественная характеристика разности давлений по обе стороны искривленной поверхности выражается законом Лапласа – основным законом в теории капиллярности:
p |
dS |
, где |
dS |
– кривизна поверхности. |
|
dV |
dV |
||||
|
|
|
Если центр кривизны лежит внутри жидкости, то кривизна положительна, если вне жидкости – отрицательна.
Из уравнения видно, что в фазе, имеющей положительную кривизну межфазной поверхности, давление больше, чем внутри фазы с отрицательной кривизной. Капиллярное давление всегда направлено к центру кривизны! Например, в столбике ртути, не смачивающей
стеклянный капилляр (положительная кривизна dVdS 0 , т. к. центр кривизны внутри фазы),
давление ртути больше, чем в насыщенном паре над жидкой ртутью в капилляре. Если в капилляре находится смачивающая его вода, то радиус кривизны жидкой фазы будет
отрицательным dVdS 0 , а давление в этой фазе меньше, чем в насыщенном паре.
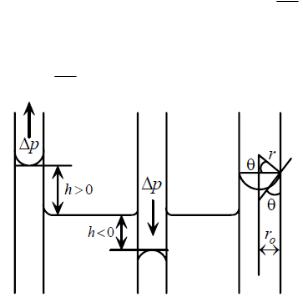
Рисунок 18 – Капиллярные явления
Как уже отмечалось выше, жидкость в капилляре может быть выше или ниже уровня жидкости в сосуде, куда опущен капилляр. Это зависит от того, смачивается капилляр жидкостью или нет. В первом случае жидкость будет подниматься, т. к. радиус кривизны жидкости отрицательный и дополнительное давление направлено в сторону газообразной фазы (в центр кривизны). Во втором случае жидкость будет опускаться (радиус кривизны жидкости положительный, дополнительное давление направлено внутрь жидкости). Два описанных варианта капиллярного движения жидкости схематически представлены на рисунках а и б.
Очевидно, что движение жидкости будет происходить до тех пор, пока давление Лапласа не уравновесится гидростатическим давлением столба жидкости высотой h. Для состояния равновесия можно записать равенство:
p 2 r o gh ,
где ρ – плотность жидкости; ρо – плотность газовой фазы; g – ускорение свободного падения; r – радиус мениска.
Из рисунка в выразим радиус капилляра ro через радиус мениска r и угол смачивания θ: rо=r∙cos θ. Тогда высоту капиллярного поднятия (опускания) можно выразить формулой Жюрена:
h |
2 cos |
|||
|
|
|
. |
|
r ( |
o |
)g |
||
|
o |
|
|
|
По формуле Жюрена можно рассчитать высоту капиллярного поднятия или опускания жидкости в зависимости от степени смачиваемости жидкостью материала капилляра, его радиуса и плотностей жидкой и газообразной фаз. Из анализа формулы следует, что если жидкость не смачивает капилляр (краевой угол θ>90°, а cos θ<0), то величина h будет отрицательной (плотность любой жидкости больше плотности воздуха), т. е. жидкость в капилляре опускается ниже уровня жидкости в сосуде. При смачивании будет наблюдаться обратная зависимость.
Итак, искривление поверхности вызывает повышение или понижение давления в фазе по сравнению с плоской поверхностью фазы такого же химического состава. Очевидно, что это приводит к изменению термодинамических параметров вещества, которые определяют его физические свойства и реакционную способность. Понятие термодинамическая реакционная способность вещества характеризует его способность изменять химический или фазовый состав, т. е. вступать в химическую реакцию или переходить в новую фазу (например, испаряться или конденсироваться, растворяться).
Для процесса испарения вещества зависимость давления насыщенного пара над жидкостью от кривизны поверхности выражается уравнением Кельвина (Томсона):
ln |
p |
|
2 Vм |
, |
|
|
|||
|
pS |
|
rRT |
|
где P – давление насыщенного пара над искривленной поверхностью; PS – давление насыщенного пара над плоской поверхностью; Vм – молярный объем жидкости.
Знак «-» соответствует вогнутой поверхности (кривизна отрицательна), а знак «+» - выпуклой поверхности (кривизна положительна).
Данное уравнение может быть применено для установления условий равновесия жидкости и пара при наличии между ними искривленной поверхности (например, в случае жидкости в капилляре или жидкости в виде капли). Из анализа уравнения Кельвина можно сделать вывод о том, что при положительной кривизне жидкости (капля в невесомости или на поверхности твердого тела при отсутствии или неполной смачиваемости) над ней создается повышенное по сравнению с плоской поверхностью давление пара, т. е. испаряется больше жидкости. При отрицательной кривизне (жидкость, смачивающая капилляр) количество испарившейся жидкости в равновесии с ее паром будет меньше по сравнению с плоской поверхностью; иными словами, конденсация будет происходить при меньшем давлении паров. Такое явление известно под названием «капиллярная конденсация».
Анализ полученного уравнения приводит к ряду важных следствий:
1.Давление насыщенного пара жидкости Ps над плоской поверхностью (поверхность с бесконечно большим радиусом кривизны) меньше, чем давление пара P над каплей радиуса r. Однако оно больше, чем давление пара над вогнутой поверхностью.
2.Чем меньше размер капли, тем больше равновесное давление ее насыщенного пара и, следовательно, тем выше значение химического потенциала жидкости, то есть тем менее устойчиво ее состояние. Если в системе одновременно присутствуют капли различных размеров, давление насыщенного пара над ними различно. Поэтому мелкие капли, обладая большим давлением пара, испаряются; испаряющееся вещество будет конденсироваться на поверхности более крупных частиц и на плоской поверхности. Такой процесс роста крупных капель за счет
испарения мелких капель носит название изотермической перегонки или переконденсации.
3. Равновесие твердых частиц по отношению к жидкому раствору можно выразить уравнением, сходным с уравнением Томсона
Аналогия с каплей вызывается тем, что доля поверхностных молекул, несущих избыточную энергию, в мелкокристаллическом веществе также велика. Поэтому при растворении высокодисперсного вещества можно получить концентрацию раствора выше обычной растворимости. Термодинамическая неравновесность таких систем обуславливает перекристаллизацию вещества - рост крупных кристаллов в перенасыщенном растворе за счет растворения мелких. Уравнение дает возможность, исследуя растворимость как функцию размеров частиц, рассчитывать значения межфазного натяжения на границе твердое тело - жидкость.
Уравнение, устанавливающее зависимость между равновесной растворимостью твердых тел и размером частиц (который определяет кривизну их поверхности) получено Гиббсом, Фрейндлихом и Оствальдом и носит их имена:
