
- •Понятие об эквиваленте. Эквивалент сложных веществ. Изменение эквивалента веществ, при вступлении их в химические реакции. Закон эквивалентов.
- •Теоретические основы объемного анализа. Классификация методов объемного анализа по реакции, лежащей в их основе и по способу титрования. Расчеты, применяемые в объемном анализе.
- •Перманганатометрия. Определение активности каталазы крови.
- •Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине c.
- •Окислительно-восстановительные реакции. Зависимость эквивалента окислителя и восстановителя от реакции среды.
- •Типы окислительно-восстановительных реакций.
- •Аргенометрия. Методы Мора и Фольгарда.
- •Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •Типы сложных химических реакций.
- •Уравнение кинетики реакции 1 порядка. Период полупревращения.
- •Уравнения кинетики реакции 2 порядка.
- •Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Ферменты как биологические катализаторы и их классификация.
- •Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •Способы выражения концентрации растворов.
- •Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •Повышение температуры кипения растворов. Эбуллиоскопическая постоянная.
- •Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •Теория кислот и оснований. Сильные и слабые электролиты. Степень диссоциации.
- •Константа диссоциации. Закон разбавления Освальда.
- •Электролиты в организме человека.
- •Протолитическая теория кислот и оснований.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Гидролиз солей. Степень гидролиза.
- •Константа гидролиза соли, образованной сильным основанием и слабой кислотой (вывод уравнения).
- •Константа гидролиза соли, образованной слабым основанием и сильной кислотой (вывод реакции).
- •Константа гидролиза соли, образованной слабым основанием и слабой кислотой.
- •Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •Уравнение Гендерсона-Гассельбаха для расчета pH буферных систем (вывод).
- •Буферные системы крови.
- •Методы получения коллоидных растворов.
- •Методы очистки коллоидных растворов. Искусственная почка.
- •Строение коллоидных частиц. Строение мицеллы.
- •Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
-
Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
Осмос – массоперенос растворителя через полупроницаемую мембрану и разбавленного раствора в раствор более высокой концентрации.
Осмотическое давление – давление, необходимое создать с той стороны мембраны, где находится раствор, чтобы приостановить осмос.
Все полупроницаемые мембраны можно разделить на 3 группы:
Ткани животных и растений (такие как стенки мочевого пузыря, стенки кишечника и т.д.)
Искусственно получаемые органические мембраны (пленки из желатина, ацетилцеллюлозы и т.д.)
Неорганические мембраны (из металлов, керамики и др.)
Осмотическое давление разбавленного раствора неэлектролита прямопропорционально молярной концентрации, коэффициентной пропорциональности и абсолютной температуре.
П=CRT,
где R-
универсальная газовая постоянная. Так
как C=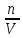 , где n-
число молей неэлектролита, а V-
объем раствора, то П=
, где n-
число молей неэлектролита, а V-
объем раствора, то П= RT
или ПV=nRT
П=mRT,
где m-
молярная концентрация растворителя.
Если взять RT
как K,
то можно записать П=Km.
RT
или ПV=nRT
П=mRT,
где m-
молярная концентрация растворителя.
Если взять RT
как K,
то можно записать П=Km.
Осмотическое давление в биологических жидкостях определяется коллигативными свойствами частиц, составляющих эти жидкости, а именно HMC, BMC, ФЭ – форменных элементов (эритроциты, лейкоциты, тромбоциты) и некоторых других факторов.
Суммарное для крови:
Пкр.=ПНМС+ПВМС+Q+ПФЭ-Р.
Растворы, обладающие при одинаковых условиях одинаковым осмотическим давлением, называются изотоническими.
Закон Вант-Гоффа: осмотическое давление раствора численно равно тому давлению, которое производило бы данное количество растворенного вещества, если бы оно в виде идеального газа занимало при данной температуре объем, равный объему раствора.
PоснV = RT
У растворов электролитов более высокое, чем по закону Вант-Гоффа, осмотическое давление. Исходя из этого, Вант-Гофф внес уравнение для растворов электролитов:
П=iСлТ
i-для
неэлектролитов
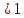 ,
а для электролитов
,
а для электролитов
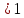 .
.
Изотонический коэффициент показывает во сколько раз наблюдаемое осмотическое давление раствора больше теоретически вычисленного.
i=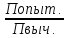 ,
тогда
i=
,
тогда
i=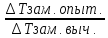 =
=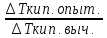
∆Тзам.=iKm
∆Ткип.=iEm
-
Понижение температуры замерзания растворов. Криоскопическая постоянная.
С давлением насыщенного пара тесно связаны такие свойства растворов, как температура кипения и температура замерзания. Жидкость замерзает тогда, когда давление ее насыщенного пара над жидкостью будет равно давлению насыщенного пара над твердой фазой (льдом). Так как давление насыщенного пара над раствором меньше, чем над чистым растворителем (водой), то для закипания раствора требуется более высокая, а для замерзания – более низкая температура, чем для растворителя (воды).
Повышение температуры кипения tкип или Понижение температуры замерзания (кристаллизации) tзам растворов по сравнению с чистым растворителем прямо пропорционально молярности раствора.
tзам = C m К, где К – криоскопическая постоянная, Сm – молярность.
Криоскопическая постоянная – разница между температурой замерзания раствора и температурой чистого растворителя.
-
Повышение температуры кипения растворов. Эбуллиоскопическая постоянная.
С давлением насыщенного пара тесно связаны такие свойства растворов, как температура кипения и температура замерзания.
Жидкость закипает тогда, когда давление насыщенного пара над ней равно внешнему (атмосферному) давлению. Повышение температуры кипения tкип растворов по сравнению с чистым растворителем прямо пропорционально молярности раствора.
tкип = C m E , где Е– эбуллиоскопическая постоянная, Сm – молярность.
Эбуллиоскопическая постоянная – разница между температурой кипения раствора и температурой чистого растворителя.
