
- •Понятие об эквиваленте. Эквивалент сложных веществ. Изменение эквивалента веществ, при вступлении их в химические реакции. Закон эквивалентов.
- •Теоретические основы объемного анализа. Классификация методов объемного анализа по реакции, лежащей в их основе и по способу титрования. Расчеты, применяемые в объемном анализе.
- •Перманганатометрия. Определение активности каталазы крови.
- •Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине c.
- •Окислительно-восстановительные реакции. Зависимость эквивалента окислителя и восстановителя от реакции среды.
- •Типы окислительно-восстановительных реакций.
- •Аргенометрия. Методы Мора и Фольгарда.
- •Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •Типы сложных химических реакций.
- •Уравнение кинетики реакции 1 порядка. Период полупревращения.
- •Уравнения кинетики реакции 2 порядка.
- •Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Ферменты как биологические катализаторы и их классификация.
- •Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •Способы выражения концентрации растворов.
- •Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •Повышение температуры кипения растворов. Эбуллиоскопическая постоянная.
- •Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •Теория кислот и оснований. Сильные и слабые электролиты. Степень диссоциации.
- •Константа диссоциации. Закон разбавления Освальда.
- •Электролиты в организме человека.
- •Протолитическая теория кислот и оснований.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Гидролиз солей. Степень гидролиза.
- •Константа гидролиза соли, образованной сильным основанием и слабой кислотой (вывод уравнения).
- •Константа гидролиза соли, образованной слабым основанием и сильной кислотой (вывод реакции).
- •Константа гидролиза соли, образованной слабым основанием и слабой кислотой.
- •Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •Уравнение Гендерсона-Гассельбаха для расчета pH буферных систем (вывод).
- •Буферные системы крови.
- •Методы получения коллоидных растворов.
- •Методы очистки коллоидных растворов. Искусственная почка.
- •Строение коллоидных частиц. Строение мицеллы.
- •Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
-
Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
Кинетика-наука, изучающая механизм и закономерности протекания химических реакций. В хим.кинетике используется графический метод изображения функциональных зависимостей.
A→B
(график)
Vср.= потому что скорость реакции не может
быть отрицательной Vср.=-
потому что скорость реакции не может
быть отрицательной Vср.=-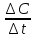 поэтому пишем Vср.=
поэтому пишем Vср.=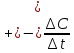 =
=
Скоростью химической реакции называется изменение концентрации реагирующих веществ в единицу времени.
Vср.=lim( )
)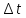 →0=
→0=
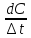 =tgα
=tgα
-
Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
Кинетика базируется на законе действующих масс: скорость химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
V=kCA1V1CA2V2CA3V3
Например:
N2+3H2=2NH3
Vпр.=k1[N2][H2]3
Vобр.=k2[NH3]2
По закону действующих масс можно рассчитать скорость реакции в данный момент времени.
C+O2 V=K[O2]
При увеличении концентрации реагирующих веществ и давления, скорость увеличивается.
-
Молекулярность и порядок реакции. Лимитирующая стадия процесса.
Молекулярностью реакции считается число молекул, участвующих в элементарном акте химического взаимодействия. Они делятся на:
Мономолекулярные I2=2I
Бимолекулярные H2+Cl2=2HCl
Тримолекулярные 2NO+O2=2NO2
Порядок реакции определяется суммой степеней входящих в закон действующих масс для определения скорости этой реакции.
H2+Cl2=2HCl
V=K[H2][Cl] V1=1+1=2
Если реакция осуществляется путем последовательно протекающих стадий (не обязательно все из них являются химическими) и одна из этих стадий требует значительно большего времени, чем остальные, то есть идет намного медленнее, то такая стадия называется лимитирующей. Именно эта самая медленная стадия определяет скорость всего процесса.
-
Типы сложных химических реакций.
Параллельные реакции
A→B
↓
C
6HClo3→B 2KCl+3O2
↓
3KClO2+KCl
Последовательные реакции
A→B→C→D
C6H32O6+H2O=C6H12O11+C6H12O6
C12H12O11+H2O=C6H12O6+C6H12O6
Обратимые реакции
A+B+C↔A1B1+C1
CH3COOH+C2H5OH↔CH3COOC2H5+H2O
Сопряженные реакции
A+B→M/a
A+B→N/b
Цепные реакции
Cl+H2=HCl+H
H+Cl2=HCl+Cl
-
Уравнение кинетики реакции 1 порядка. Период полупревращения.
Реакции 1 порядка – реакции в уравнениях скорости которых входит концентрация реагирующего вещества в 1 степени.
CH3COOC2H5+H2O=CH3COOH+C2H5OH
V=K[CH2COOC2H5]
Периодом
полупревращения для реакции 1 порядка
называется время, за которое реагирует
ровно половина исходного вещества.
Приравнив a-x=a/r,получим:
K=
В ракции 1 порядка скорость пропорциональна концентрации реагента.
V= =k(a-x)
=k(a-x)
-
Уравнения кинетики реакции 2 порядка.
Реакции 2 порядка – реакции, скорость которых пропорциональна квадрату концентраций.
2HCl=Cl2+H2 V=K[HCl]2
CH3COOH+C2H5OH=CH3COOC2H5+H2O
V=K[CH3COOH] [C2H5OH]
Реакции 2 порядка можно представить так: A+B=C V=[A] [B]
Обозначим
концентрацию реагирующего вещества в
момент времени t
x
моль/п вещество А взаимодействует с x
моль/т вещества B,
то останется (а-х) моль/п вещества А и
(в-х) моль/п вещества В. Скорость реакции
пропорциональна концентрации 2 реагирующих
веществ в каждый момент времени.
Выражается как V= =K[A]
[B]
=K[A]
[B]
