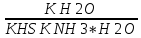- •Понятие об эквиваленте. Эквивалент сложных веществ. Изменение эквивалента веществ, при вступлении их в химические реакции. Закон эквивалентов.
- •Теоретические основы объемного анализа. Классификация методов объемного анализа по реакции, лежащей в их основе и по способу титрования. Расчеты, применяемые в объемном анализе.
- •Перманганатометрия. Определение активности каталазы крови.
- •Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине c.
- •Окислительно-восстановительные реакции. Зависимость эквивалента окислителя и восстановителя от реакции среды.
- •Типы окислительно-восстановительных реакций.
- •Аргенометрия. Методы Мора и Фольгарда.
- •Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •Типы сложных химических реакций.
- •Уравнение кинетики реакции 1 порядка. Период полупревращения.
- •Уравнения кинетики реакции 2 порядка.
- •Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Ферменты как биологические катализаторы и их классификация.
- •Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •Способы выражения концентрации растворов.
- •Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •Повышение температуры кипения растворов. Эбуллиоскопическая постоянная.
- •Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •Теория кислот и оснований. Сильные и слабые электролиты. Степень диссоциации.
- •Константа диссоциации. Закон разбавления Освальда.
- •Электролиты в организме человека.
- •Протолитическая теория кислот и оснований.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Гидролиз солей. Степень гидролиза.
- •Константа гидролиза соли, образованной сильным основанием и слабой кислотой (вывод уравнения).
- •Константа гидролиза соли, образованной слабым основанием и сильной кислотой (вывод реакции).
- •Константа гидролиза соли, образованной слабым основанием и слабой кислотой.
- •Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •Уравнение Гендерсона-Гассельбаха для расчета pH буферных систем (вывод).
- •Буферные системы крови.
- •Методы получения коллоидных растворов.
- •Методы очистки коллоидных растворов. Искусственная почка.
- •Строение коллоидных частиц. Строение мицеллы.
- •Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
-
Гидролиз солей. Степень гидролиза.
Гидролиз солей- взаимодейтсвие солей с водой, приводящее к присоединению протона Н+молекулы воды к аниону кислотного остатка или гидроксогруппы ОН- к катиону металла. Гидролизу подвергаются соли, образованные катионами, соответствующими слабым основаниям, или анионами, соответствующими слабым кислотам.
Соль образована слабым основанием и сильной кислотой.
CuCl2=Cu2++2Cl-
H2O ↔H++OH-
Cu2++H2O ↔CuOH++H+
Образуется слабодиссоциируемый катион CuOH+. Среда в растворе кислая.
CuCl2+H2O↔CuOHCl+HCl
Соль образована сильным основанием и слабой кислотой.
Na2CO3=2Na++CO32-
H2O ↔H++OH-
CO32-+H2O ↔HCO3-+OH-
Образуется слабодиссоциируемый анион HCO3-. Среда- щелочная.
Na2CO3+H2O↔NaHCO3+NaOH
Соль образована слабой кислотой и слабым основанием.
(NH4)S=2NH4++S2-
NH4++H2O↔NH3· H2O+H+
S2-+H2O↔HS-+OH-
Образуется слабодиссоциированный анион HS- и растворенный в воде аммиак.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр): α = (cгидр/cобщ)·100 % где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли. Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
-
Константа гидролиза соли, образованной сильным основанием и слабой кислотой (вывод уравнения).
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
Для соли, образованной слабой кислотой и сильным основанием:
Kг=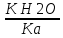 ,
где Ka —
константа диссоциации слабой кислоты,
образующейся при гидролизе.
,
где Ka —
константа диссоциации слабой кислоты,
образующейся при гидролизе.
Na2CO3=2Na++CO32-
H2O ↔H++OH-
CO32-+H2O ↔HCO3-+OH-
Na2CO3+H2O↔NaHCO3+NaOH
Кг=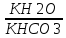
-
Константа гидролиза соли, образованной слабым основанием и сильной кислотой (вывод реакции).
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
Для соли, образованной сильной кислотой и слабым основанием:
Kг=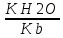 ,
где Kb —
константа диссоциации слабого основания,
образующегося при гидролизе.
,
где Kb —
константа диссоциации слабого основания,
образующегося при гидролизе.
CuCl2=Cu2++2Cl-
H2O ↔H++OH-
Cu2++H2O ↔CuOH++H+
CuCl2+H2O↔CuOHCl+HCl
Кг=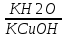
-
Константа гидролиза соли, образованной слабым основанием и слабой кислотой.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
Для соли, образованной слабой кислотой и слабым основанием:
Kг=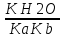 ,где
Ka —
константа диссоциации слабой кислоты,
образующейся при гидролизе, Kb —
константа диссоциации слабого основания,
образующегося при гидролизе
,где
Ka —
константа диссоциации слабой кислоты,
образующейся при гидролизе, Kb —
константа диссоциации слабого основания,
образующегося при гидролизе
(NH4)S=2NH4++S2-
NH4++H2O↔NH3· H2O+H+
S2-+H2O↔HS-+OH-
Kг=