
- •Понятие об эквиваленте. Эквивалент сложных веществ. Изменение эквивалента веществ, при вступлении их в химические реакции. Закон эквивалентов.
- •Теоретические основы объемного анализа. Классификация методов объемного анализа по реакции, лежащей в их основе и по способу титрования. Расчеты, применяемые в объемном анализе.
- •Перманганатометрия. Определение активности каталазы крови.
- •Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине c.
- •Окислительно-восстановительные реакции. Зависимость эквивалента окислителя и восстановителя от реакции среды.
- •Типы окислительно-восстановительных реакций.
- •Аргенометрия. Методы Мора и Фольгарда.
- •Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •Типы сложных химических реакций.
- •Уравнение кинетики реакции 1 порядка. Период полупревращения.
- •Уравнения кинетики реакции 2 порядка.
- •Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Ферменты как биологические катализаторы и их классификация.
- •Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •Способы выражения концентрации растворов.
- •Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •Повышение температуры кипения растворов. Эбуллиоскопическая постоянная.
- •Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •Теория кислот и оснований. Сильные и слабые электролиты. Степень диссоциации.
- •Константа диссоциации. Закон разбавления Освальда.
- •Электролиты в организме человека.
- •Протолитическая теория кислот и оснований.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Гидролиз солей. Степень гидролиза.
- •Константа гидролиза соли, образованной сильным основанием и слабой кислотой (вывод уравнения).
- •Константа гидролиза соли, образованной слабым основанием и сильной кислотой (вывод реакции).
- •Константа гидролиза соли, образованной слабым основанием и слабой кислотой.
- •Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •Уравнение Гендерсона-Гассельбаха для расчета pH буферных систем (вывод).
- •Буферные системы крови.
- •Методы получения коллоидных растворов.
- •Методы очистки коллоидных растворов. Искусственная почка.
- •Строение коллоидных частиц. Строение мицеллы.
- •Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
-
Перманганатометрия. Определение активности каталазы крови.
Перманганатометрическое титрование основано на взаимодействии стандартного раствора перманганата калия с раствором восстановителя.
Окисление перманганатом калия можно проводить в кислой, щелочной и нейтральной средн, причем продукты восстановления KMnO4 в разных средах различны.
В кислой среде.
ЭKMnO4=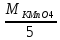
В щелочной среде.
ЭKMnO4=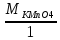
В нейтральной среде.
ЭKMnO4=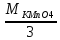
Перманганатометрическое титрование рекомендуется проводить в кислой среде, т.к. одна избыточная капля титранта окрасит титруемый раствор в розовый цвет и окислительная способность перманганата калия в кислой среде намного больше, чем в щелочной и нейтральной.
Титрованием раствора крови перманганатом калия можно определить активность каталазы крови. По результатам титрований определяем каталазное число, которое в норме должно колеблется от 10 до 15 единиц.
-
Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине c.
В основе метода лежит реакция: I2+2е-=2I-
В отличие от таких окислителей, как перманганат калия или дихромат калия, свободный йод является относительно слабым окислителем. Наоборот, йодиды, содержащие ионы I-, значительно более сильные восстановители, чем ионы Cr+3 и Mn+2. Это показывает, что существует ряд восстановителей, способных окисляться свободным йодом. Имеется также ряд окислителей, способных восстанавливаться йодом. Такие окислители по отношению к иону йода будут направлять реакцию в сторону выделения свободного йода: 2I--2е-=I2.
Очень чувствительным индикатором в йодометрии является раствор крахмала, который дает с йодом непрочное соединение интенсивно синего цвета.
Йодометрическое титрование нельзя проводить в щелочной среде, т.к. йод реагирует со щелочами: I2+2OH-=IO-+I-+H2O.
Присутствие же гипойода IO- недопустимо, т.к. он является более сильным окислителем чем йод и окисляет тиосульфат частично до сульфата: S2O3-2+4IO-+2OH-=4I-+2SO4-2+H2O.
Аскорбиновую кислоту можно определить с помощью титрования йодом его раствора с добавленным раствором крахмала, после чего вычисляется процентное соотношение в контрольном растворе, зная взятую навеску.
-
Окислительно-восстановительные реакции. Зависимость эквивалента окислителя и восстановителя от реакции среды.
Окислительно-восстановительными называются реакции, в результате которых изменяются степени окисления одного или нескольких веществ.
Mg0+Cl20=Mg+2Cl2-
Mg0-2е-=Mg+2-восстановитель окисляется
Cl20+2е-=2Cl—окислитель восстанавливается.
Эквивалентом окислителя (восстановителя) называется такое его количество, которое, восстанавливаясь (окисляясь), присоединяет (высвобождает) 1 моль электронов.
Эквивалентная
масса окислителя (восстановителя) Э
равна его молярной массе М, деленной на
число электронов n,
которые присоединяет (высвобождает)
одна молекула окислителя (восстановителя)
в данной реакции: Э=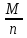 (г/моль).
(г/моль).
-
Типы окислительно-восстановительных реакций.
В зависимости от того в каких веществах находятся окислитель и восстановитель, ОВР делятся на 3 типа:
Межмолекулярные реакции.
2KI-+Cl20=I20+2KCl-.
2I-2е-=I20-восстановитель окисляется
Cl2+2е-=2Cl—окислитель восстанавливается
Внутримолекулярные реакции.
2KCl+5O3-2=2KCl-+3O20
Cl+5+6е-=Cl—окислитель восстанавливается
2O-2-4е-=O20-восстановитель окисляется
Реакции самоокисления.
4H3P+3O3=3H3P+5O4+P-3H3
P+3-2е-=P+5-восстановитель окисляется
P+3+6е-=P-3-окислитель восстанавливается.
