
- •Понятие об эквиваленте. Эквивалент сложных веществ. Изменение эквивалента веществ, при вступлении их в химические реакции. Закон эквивалентов.
- •Теоретические основы объемного анализа. Классификация методов объемного анализа по реакции, лежащей в их основе и по способу титрования. Расчеты, применяемые в объемном анализе.
- •Перманганатометрия. Определение активности каталазы крови.
- •Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине c.
- •Окислительно-восстановительные реакции. Зависимость эквивалента окислителя и восстановителя от реакции среды.
- •Типы окислительно-восстановительных реакций.
- •Аргенометрия. Методы Мора и Фольгарда.
- •Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •Типы сложных химических реакций.
- •Уравнение кинетики реакции 1 порядка. Период полупревращения.
- •Уравнения кинетики реакции 2 порядка.
- •Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Ферменты как биологические катализаторы и их классификация.
- •Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •Способы выражения концентрации растворов.
- •Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •Повышение температуры кипения растворов. Эбуллиоскопическая постоянная.
- •Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •Теория кислот и оснований. Сильные и слабые электролиты. Степень диссоциации.
- •Константа диссоциации. Закон разбавления Освальда.
- •Электролиты в организме человека.
- •Протолитическая теория кислот и оснований.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Гидролиз солей. Степень гидролиза.
- •Константа гидролиза соли, образованной сильным основанием и слабой кислотой (вывод уравнения).
- •Константа гидролиза соли, образованной слабым основанием и сильной кислотой (вывод реакции).
- •Константа гидролиза соли, образованной слабым основанием и слабой кислотой.
- •Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •Уравнение Гендерсона-Гассельбаха для расчета pH буферных систем (вывод).
- •Буферные системы крови.
- •Методы получения коллоидных растворов.
- •Методы очистки коллоидных растворов. Искусственная почка.
- •Строение коллоидных частиц. Строение мицеллы.
- •Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
-
Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
Для ферментов характерна термолабильность-зависимость и активация от температуры. Это объясняетя тем, что при высокой темп. Происходит денатурация белка.
Правило Вант-Гоффа-эмпирическое правило, позволяющее в первом приближении оценить влияние t на скорость хим.реакции в небольшом интервале: при повышении t на каждые 10 градусов константа скорости гомогенной реакции увеличивается в 2-4 раза.
V2=V1
γ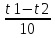
Температурный коэффициент различных реакций различен. При обычных температурах его значение для большинства реакций лежит в пределах от 2 до 4. Это на первый взгляд небольшое значение температурного коэффициента обусловливает, однако, большое возрастание скорости реакции при значительном повышении температуры. Например, если температурный коэффициент равен 2,9, то при возрастании температуры на 100 градусов скорость реакции увеличивается на 2,9'°, т.е. приблизительно в 50000 раз.
-
Энергия активации. Уравнение Аррениуса.
Ур.Аррениуса устанавливает зависимость константы скорости хим.реакции от температуры.
K=Ae-Ea/RT
Энергия активации- минимальное кол-во энергии, необходимое сообщить системе, чтобы произошла реакция.
Если известны K1 и K2 для температур T1 и T2, то энергия активации рассчитывается по формуле Аррениуса:
lg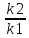 =
=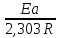 (
(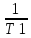 -
-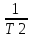 )
)
Уравнение
показывает, что зависимость lg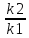 от
от
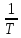 дает прямую линию.
дает прямую линию.
(график)
Чем меньше энергия активации, тем больше скорость реакции. Скорость энергии активации зависит от числа эффективных столкновений.
-
Катализ и катализаторы. Гомогенный, гетерогенный и микрогетерогенный катализ.
Изменение скорости реакции при участии катализаторов заключается в снижении энергии активации протекающего процесса по сравнению с энергией активации соответствующей некатализируемой реакции.
Катализаторы-вещества, изменяющие скорость реакции.\
Все каталитические реакции можно разделить на:
Гомогенный катализ (в одной фазе).
2SO2+O2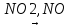 2SO3
2SO3
SO2+NO2=SO3+NO
NO+1/2O2=NO2
Гетерогенный катализ-протекает на поверхности раздела двух фаз (на поверхности катализатора).
2H2O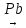 H2O+O2
H2O+O2
Гетерогенные каталитические реакции протекают в несколько стадий:
-приближение реагентов к поверхности катализатора
-адсорбция и ориентация к поверхности катализатора
-деформация связей в молекулах
-химические превращения активных молекул
-десорбция и удаление продуктов реакции с поверхности катализатора
Микрогетерогенный катализ-связан с ферментативными процессами.
-
Ферменты как биологические катализаторы и их классификация.
Ферменты представляют собой белки со строго специализированными функциями.
В растворах, в которых существуют ферментативные процессы, нет типичной гетерогенности, т.к. нет четко выраженной поверхности раздела у фаз.
Все ферменты классифицируются по характеру их действия, т.е. учитывается природа химических превращений, катализируемых данными ферментами. Согласно современной классификации все ферменты делятся на 6 больших групп:
Оксидоредуктазы (окислительно-восстановительные действия)
Трансферазы (каталитический перенос различных веществ)
Гидролазы (катализирующие реакции гидролитического расщепления)
Лиазы (катализируют присоединение групп к двойным связям или отрыв от этих групп)
Изомеразы (реакции изомеризации)
Лигазы (особая группа ферментов, катализирующих соединения двух молекул, сопряженные с распадом связей АТФ)
