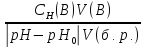- •Понятие об эквиваленте. Эквивалент сложных веществ. Изменение эквивалента веществ, при вступлении их в химические реакции. Закон эквивалентов.
- •Теоретические основы объемного анализа. Классификация методов объемного анализа по реакции, лежащей в их основе и по способу титрования. Расчеты, применяемые в объемном анализе.
- •Перманганатометрия. Определение активности каталазы крови.
- •Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине c.
- •Окислительно-восстановительные реакции. Зависимость эквивалента окислителя и восстановителя от реакции среды.
- •Типы окислительно-восстановительных реакций.
- •Аргенометрия. Методы Мора и Фольгарда.
- •Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •Типы сложных химических реакций.
- •Уравнение кинетики реакции 1 порядка. Период полупревращения.
- •Уравнения кинетики реакции 2 порядка.
- •Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Ферменты как биологические катализаторы и их классификация.
- •Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •Способы выражения концентрации растворов.
- •Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •Повышение температуры кипения растворов. Эбуллиоскопическая постоянная.
- •Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •Теория кислот и оснований. Сильные и слабые электролиты. Степень диссоциации.
- •Константа диссоциации. Закон разбавления Освальда.
- •Электролиты в организме человека.
- •Протолитическая теория кислот и оснований.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Гидролиз солей. Степень гидролиза.
- •Константа гидролиза соли, образованной сильным основанием и слабой кислотой (вывод уравнения).
- •Константа гидролиза соли, образованной слабым основанием и сильной кислотой (вывод реакции).
- •Константа гидролиза соли, образованной слабым основанием и слабой кислотой.
- •Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •Уравнение Гендерсона-Гассельбаха для расчета pH буферных систем (вывод).
- •Буферные системы крови.
- •Методы получения коллоидных растворов.
- •Методы очистки коллоидных растворов. Искусственная почка.
- •Строение коллоидных частиц. Строение мицеллы.
- •Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
-
Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
Ступенчатому гидролизу подвергаются соли, образованные:
-многоосновной слабой кислотой,
-многоосновным слабым гидроксидом,
-тем и другим одновременно.
Если соль образована слабоой мноосновной кислотой и сильным основанием, то число ступеней зависит от основности слабой кислоты. В водном растворе таких солей по первой ступени гидролиза образуется кислая соль вместо кислоты и сильное основание.
1)K2CO3+HOH↔KOH+KHCO3
2K+CO3+H2O↔K+OH+K+HCO3
CO2+H2O↔OH+HCO3
2)KHCO3+HOH↔KOH+H2CO3
K+HCO3+H2O↔K+OH+H2CO3
HCO3+H2O↔OH+H2CO3
Если соль образована слабым основанием и сильной кислотой, то число ступеней зависит от кислотности слабого основания. В водных растворах таких солей по первой ступени образуется основная соль вместо основания и сильная кислота.
1)NiCl2+HOH↔NiOHCl+HCl
Ni+2Cl+H2O↔NiOH+Cl+H
Ni+H2O↔NiOH+H
NiOHCl+HOH↔Ni(OH)2+HCl
NiOH+Cl+H↔Ni(OH)2+H+Cl
NiOH+H2O↔Ni(OH)2+H
Связь константы гидролиза со степенью гидролиза выводится подобно закону разбавления Оствальда и записывается так:
Kг=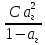 ,
где C –
концентрация соли в моль/л.
,
где C –
концентрация соли в моль/л.
Для малых значений αг:
|
|
|
|
Kг=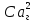 и αг=
и αг=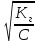
-
Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
Буферные растворы — это растворы, величина рН которых мало изменяется при добавлении к ним небольших количеств сильных кислот или щелочей, а также при разбавлении. C точки зрения протонной теории простейший буферный раствор состоит из слабой кислоты и сопряженного ей основания или слабого основания и его сопряженной кислоты.
Классификация буферных систем 1. Кислотные. Состоят из слабой кислоты и соли этой кислоты. Например, ацетатная буферная система (CH3COOH+ СН3СООNa ), гидрокарбонатная буферная система (H2CO3 +NaHCO3 ). 2. Основные. Состоят из слабого основания и его соли. Например, аммиачная буферная система (NH3H2O + NH4Cl). 3. Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3+Na2CO3 ), фосфатная буферная система (КН2PO4 + К2НPO4). 4. Аминокислотные и белковые. Если суммарный заряд молекулы аминокислоты или белка равен нулю (изоэлектрическое состояние), то растворы этих соединений не являются буферными. Их буферное действие начинает проявляться тогда, когда к ним добавляют некоторое количество кислоты или щелочи.
Механизм действия буферных систем:
1. Разбавление. При разбавлении водой происходит уменьшение концентрации обоих компонентов в буферной системе в одинаковой степени, поэтому величина их соотношения не изменится. рК(кислоты) и рК(основания) являются постоянными при данной температуре и не зависят от разбавления. Действительно, одновременное понижение концентраций кислоты и соли в ацетатной буферной системе от 0,1М до 0,001М при разбавлении водой изменяет рН буферного раствора с 4,63 до 4,73 . Следовательно,разбавление в конечном итоге мало изменяет рН буферных систем.
2. Добавление кислот и оснований. При добавлении небольших количеств сильных кислот или оснований рН буферных систем изменяется незначительно. Например, рассмотрим ацетатный буфер:
СН3СООН / СН3СОО–
При
добавлении к ацетатному буферу небольшого
количества HCl, происходит взаимодействие
ионов Н+ с
основным компонентом буферного
раствора:
Н+ +
СН3СОО– ⇄
СН3СООН.
Степень
диссоциации СН3СООН
мала и концентрация [H+]
практически не меняется. рН буферного
раствора уменьшится, но незначительно.
Таким
образом, если к ацетатному буферу
добавить Х моль/л HCl, то уравнение для
расчета рН буферной системы принимает
вид:
рН
= рК(кислоты) +
lg 
При добавлении небольшого количества NaOH, OH-– ионы нейтрализуются кислотным компонентом буферного раствора: OH-+ СН3СООН ⇄ СН3СОО – + Н2О.
В результате этого, добавленное сильное основание заменяется эквивалентным количеством слабого сопряженного основания (СН3СОО–), которое в меньшей степени влияет на реакцию cреды. рН буферного раствора увеличивается, но незначительно.
Таким
образом, если к ацетатному буферу
добавить У моль/л NaOH, то уравнение для
расчета рН буферной системы принимает
вид:
рН
= рК(кислоты) +
lg 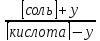
Буферная емкость (В) - это число молей эквивалента сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы сместить его рН на единицу.
Буферная
емкость системы определяется по отношению
к добавляемым кислоте (Вкисл.)
или основанию (щелочи) (Восн.)
и рассчитывается по формулам:
Вкисл.= 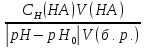 Восн.=
Восн.=