
- •Понятие об эквиваленте. Эквивалент сложных веществ. Изменение эквивалента веществ, при вступлении их в химические реакции. Закон эквивалентов.
- •Теоретические основы объемного анализа. Классификация методов объемного анализа по реакции, лежащей в их основе и по способу титрования. Расчеты, применяемые в объемном анализе.
- •Перманганатометрия. Определение активности каталазы крови.
- •Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине c.
- •Окислительно-восстановительные реакции. Зависимость эквивалента окислителя и восстановителя от реакции среды.
- •Типы окислительно-восстановительных реакций.
- •Аргенометрия. Методы Мора и Фольгарда.
- •Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •Типы сложных химических реакций.
- •Уравнение кинетики реакции 1 порядка. Период полупревращения.
- •Уравнения кинетики реакции 2 порядка.
- •Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Ферменты как биологические катализаторы и их классификация.
- •Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •Способы выражения концентрации растворов.
- •Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •Повышение температуры кипения растворов. Эбуллиоскопическая постоянная.
- •Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •Теория кислот и оснований. Сильные и слабые электролиты. Степень диссоциации.
- •Константа диссоциации. Закон разбавления Освальда.
- •Электролиты в организме человека.
- •Протолитическая теория кислот и оснований.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Гидролиз солей. Степень гидролиза.
- •Константа гидролиза соли, образованной сильным основанием и слабой кислотой (вывод уравнения).
- •Константа гидролиза соли, образованной слабым основанием и сильной кислотой (вывод реакции).
- •Константа гидролиза соли, образованной слабым основанием и слабой кислотой.
- •Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •Уравнение Гендерсона-Гассельбаха для расчета pH буферных систем (вывод).
- •Буферные системы крови.
- •Методы получения коллоидных растворов.
- •Методы очистки коллоидных растворов. Искусственная почка.
- •Строение коллоидных частиц. Строение мицеллы.
- •Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
-
Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
При изучении кинетики ферментативных реакций обычно изучают начальные скорости реакций. Зависимость скорости ферментативной реакции от концентрации субстрата:
E+S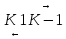 ES
ES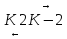 P+E
P+E
V0=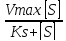
Ks-константа
диссоциации фермент-субстрата комплекса,
равная
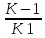
V0=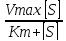
Km-константа Михаэлиса.
Km=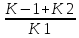
Из
уравнений видно, что они содержат
одинаковую зависимость от концентрации
субстрата, однако Ks
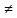 Km.
Равенство может выполняться при K-1
намного больше чем K2.
Km.
Равенство может выполняться при K-1
намного больше чем K2.
Есть 2 предельных случая:
При
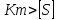
V0=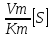 V0=Vm
V0=Vm
При
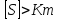
V0=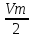
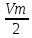 =
=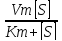 Km=
Km=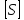
Для большинства ферментативных реакций где участвует 1 субстрат Km=от 10-2 до 10-5 (моль/л)
-
Способы выражения концентрации растворов.
Концентрация в объемном анализе может выражаться молярностью, нормальностью и титром раствора.
Молярность показывает сколько молей вещества содержится в 1л. раствора. При одинаковой молярности разные объемы растворов содержат одинаковое число молей растворенного вещества.
Нормальность показывает сколько эквивалентов растворенного вещества содержится в 1л. раствора. Растворы с одинаковой нормальностью реагируют между собой одинаковыми объемами. Растворы с различной нормальностью реагируют разными объемами. Это обратнопропорционально нормальностям.
NAVA=NBVB
или
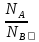 =
=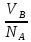
Титр - это количество грамм вещества, содержащееся в 1 мл. раствора.
T=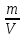 (гр/мл.) где: m-
навеска в граммах, V-
объем раствора в мл., T-
титр.
(гр/мл.) где: m-
навеска в граммах, V-
объем раствора в мл., T-
титр.
От
нормальной концентрации к титру можно
перейти по формуле: T=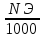 .
.
-
Коллигативные свойства растворов. Закон Рауля и следствия из него.
Некоторые физические свойства растворов зависят от числа частиц, а не от химического состава. Поскольку такие свойства обусловлены коллигативным влиянием растворенных частиц, их принято называть коллигативными (от лат. Colligatus-собирать). К числу коллигативных свойств относятся понижение давления пара над раствором, повышение температуры кипения, понижение температуры замерзания.
Растворы неэлектролитов – частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Пусть PBO – давление пара над чистым растворителем, при постоянной температуре T1; PB– давление пара растворителя при этой же температуре, но над раствором, состоящим из нелетучего компонента А (сахар), и чистым жидким растворителем В:
PB = f (T).
Разность PBO – PB равна понижению давления пара.
Величина (PBO – PB) /PBO – относительное понижение упругости пара = XA = ?P/PBO, гдеXA – мольная доля, PBO > PB, ?P = PBO – PB – абсолютное понижение упругости пара.
Закон Рауля. Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны молярной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
