
химия биополимеров
.pdf
Элементоорганические полимеры наряду с атомами углерода имеют неорганические фрагменты. По составу основных цепей их делят на три группы: 1) соединения с неорганическими цепями, обрамленными боковыми органическими группами; 2) соединения с органическими цепями, обрамленными неорганическими группами; 3) соединения с органонеорганическими основными цепями. Полимеры каждого класса делят на гомоцепные и гетероцепные.
Гомоцепные полимеры
Органические гомоцепные полимеры делятся на алифатиче-
ские (предельные и непредельные), ароматические и жирноаро-
матические углеводороды, галогенпроизводные, спирты, кислоты, амиды, эфиры, нитрилы и др. (см. табл.1)
Неорганические гомоцепные полимеры получены только из элементов III–VI групп Периодической системы, из них наибольшее практическое значение имеют полимеры из элементов IV и VI групп (см. табл.2).
Таблица 2 Примеры гомоцепных неорганических полимеров
Карбин |
–С≡ С–С≡ С– |
Кумулен |
=С=С=С= |
Полисилан |
–SiH2–SiH2–SiH2– |
Полигерман |
–GeH2–GeH2–GeH2– |
Полисера |
–S–S–S– |
Элементоорганические гомоцепные полимеры делятся не две подгруппы:
•полимеры имеют основные неорганические цепи, обрамленные органическими радикалами (например, полиорганосила-
ны –SiR2–SiR2–)
•полимеры имеют основные органические цепи, обрамленные элементоорганическими группами (например, поливинилал-
килсилены |
|
|
|
и др. |
|
|
|
|
|
11

Органические гетероцепные полимеры подразделяют на классы в зависимости от природы функциональной группы, повторяющейся в основной цепи. Различают кислород-, азот- и серусодержащие соединения (табл.3). Они могут быть алифатическими или ароматическими в зависимости от группировок между функциональными группами.
Таблица 3 Примеры органических гетероцепных полимеров
Функциональная |
|
|
Полимер |
||
группа |
|
Название |
Представители |
||
|
|
|
|
класса |
|
|
|
|
|
Кислородсодержащие |
|
Простая эфирная |
|
Простые по- |
Полиэтиленоксид |
||
–СН2–О– |
|
лиэфиры |
–СН2–СН2–О– |
||
Сложноэфирная |
|
Сложные |
Полиэтилентерефталат |
||
|
–С(О)–О– |
|
полиэфиры |
–О–(СН2)2–О–ОС–С6Н4–СО– |
|
|
|
|
|
Азотсодержащие |
|
|
|
|
|
|
|
Амидная |
|
Полиамиды |
–NH-R/–NH–С(О)–R//–C(O)– |
||
|
–NH–С(О)– |
|
|
||
Мочевиновая |
|
Полимоче- |
–NH–С(О)–NH–(СН2)9– |
||
–NH–С(О)– |
|
вины |
|
||
Уретановая |
|
Полиурета- |
–(СН2)6–NH-С(О)–O–(СН2)6– |
||
–NH–С(О)–O– |
|
ны |
|
||
|
|
|
|
Серусодержащие |
|
|
|
|
|
|
|
|
|
|
|
Полисуль- |
Полиэтиленсульфид |
|
|
|
|
фиды |
–S –СН2–СН2– |
|
|
|
|
|
|
|
Сульфоновая |
|
|
Полисуль- |
Полиоктэнсульфон |
|
– R–SO2– |
|
фоны |
–(СН2)8–SО2– |
|
12
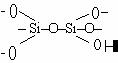
Неорганические гетероцепные полимеры построены из элементов III–VI групп Периодической системы.
Примеры:
Поликремневая кислота
Полифосфонитрилхлорид –РCl2=N–
Элементоорганические гетероцепные полимеры могут иметь основную цепь неорганическую, а обрамление – органические группы (см. табл. 4).
Таблица 4 Примеры элементоорганических гетероцепных полимеров
Полиорганосилоксаны |
– SiR2 –O – |
Полиалюмоорганосилоксаны |
–SiR2–O–Al(R/)–O–SiR2– |
Поликарбосиланы |
–SiR2–CR2/–SiR2– |
Поликарбосилоксаны |
–SiR2–O–CR2/–O–SiR2– |
У поликарбосиланов и поликарбосилоксанов между атомами кремния могут быть алифатические и ароматические звенья. На-
пример, –Si–(СН2 )n –Si–, –Si–(С6Н4)–Si–.
Природа связей между звеньями в макромолекулах. Повторяющиеся звенья в макромолекулах соединены между собой химическими ковалентными и координационными связями. Координационные связи осуществляются в результате донорноакцепторного взаимодействия. При этом донорами являются атомы, способные отдавать электроны для образования связи (О, N, S, F, Cl), а акцепторами электронов являются металлы всех групп Периодической системы (кроме пятой). Полимеры, звенья которых соединены координационными связями, называются
координационными, хелатными или клешневидными. Химиче-
ские и координационные связи имеют малую длину 0,1-0,2 нм и
13
высокую энергию (табл. 5). По величине энергия химической связи существенно превышает энергию других типов связей
(табл. 6).
Таблица 5
Значения энергии σ – связей
Связь |
Энергия связи, кДж/моль |
С–С |
336 |
С–Si |
241 |
С–S |
258 |
Si–Si |
189 |
Таблица 6
Энергии различных типов связей
Тип связи |
Энергия связи, |
|
кДж/моль |
Химическая: ионная |
590-1050 |
ковалентная |
До 710 |
металлическая |
110-350 |
Водородная |
До 50 |
Дисперсионная |
До 40 |
Ориентационная |
До 20 |
Индукционная |
До 2 |
Полярность связей
Полярность является важной характеристикой полимеров, определяющей их эксплуатационные и диэлектрические свойства, устойчивость к высоким температурам и агрессивным средам. В зависимости от полярности связей полимеры делят на полярные и неполярные. Количественно степень полярности оценивается дипольным моментом (µ), равным произведению заряда
(q) на расстояние (r) между зарядами. Дипольный момент макромолекулы равен векторной сумме дипольных моментов полярных групп в цепи.
14

К полярным относят полимеры, содержащие группы с полярными связями (С–ОН, С–СООН, С–СN, С–СОNH2, С–Cl). Полярными полимерами являются ПВС, ПАК, ПАН, ПАА, ПВХ. Неполярными полимерами являются ПЭ, ПП, ПС, ПБ.
1.2. Молекулярная масса и молекулярно-массовое распределение полимеров
Большинство синтетических полимеров состоит из макромолекул различной длины, т.е. являются полидисперсными вследствие статистического (случайного) характера элементарных реакций синтеза и возможности деструкции макромолекул. Биополимеры обычно однородны по молекулярной массе (ММ), однако при выделении полимеров некоторые связи разрушаются и биополимеры становятся полидисперсными.
Вследствие полидисперсности полимеры характеризуют средними ММ и в зависимости от типа усреднения различают
среднечисловую и среднемассовую ММ. Существуют и другие типы усреднения, так при исследовании гидродинамических свойств полимеров определяют среднегидродинамические ММ. Такие ММ определяют при измерении вязкости (средневязкост-
ная – M η), константы седиментации (среднеседиментационная –
M S) или коэффициента диффузии (среднедиффузионная – M D). Среднечисловая молекулярная масса определяется соотношением:
Здесь N – число макромолекул, xi – числовая доля макромолекул с молекулярной массой Mi. xi= Ni / ∑N i .
Экспериментально Mn измеряют методами, в основе кото-
рых лежат коллигативные свойства растворов (зависящие от числа частиц). К таким методам относят осмометрию, криоскопию, эбулиоскопию и анализ концевых групп.
15

Среднемассовая молекулярная масса определяется соотношением:
Здесь N – число макромолекул, ωi – массовая доля макромолекул с молекулярной массой Mi. ωi = Ni Mi / ∑N i Mi .
Экспериментально M ω определяют методом светорассея-
ния. Величина M ω > M n для полидисперсного образца и M ω
= M n для монодисперсного образца. Значения Mω более чувствительны к наличию в образце высокомолекулярных фракций, а
M n – к наличию низкомолекулярных фракций.
Отношение M ω/ Mn =КD называется показателем полидис-
персности. Если образец монодисперсен, то КD=1 (редкий случай). Для большинства синтетических и природных полимеров КD>1, т.е. полимеры полидисперсны, причём КD может изменяться в широких пределах (от 2 до 20). Значения показателя полидисперсности КD связаны с механизмом образования полимера. Так, КD=1,5 для продукта радикальной полимеризации при обрыве цепи рекомбинацией и КD=2 – при обрыве цепи диспропорционированием. Для полимеров, полученных поликонденсацией, КD=1 + Х, где Х – конверсия. При Х→1 (100%) КD=2.
Для характеристики полидисперсности полимеров, кроме показателя полидисперсности, используются кривые молекуляр-
но-массового распределения (ММР). Различают интегральные и дифференциальные функции ММР (рис. 1), которые могут быть числовыми и массовыми. Интегральная кривая ММР – это зависимость между ММ и интегральной массовой (или числовой) долей фракций полимера.
Дифференциальная кривая ММР представляет собой зависимость ММ от массовой [молекулярно-массовое распределение (ММР) (рис.2, кривая 2)] или числовой доли фракции [молеку-
16

лярно-числовое распределение (МЧР) (рис. 2, кривая 1)]. Кривые МЧР и ММР не совпадают, т.к на числовое распределение большое влияние оказывают низкомолекулярные фракции, а на массовое распределение влияют высокомолекулярные фракции. Абсцисса центра тяжести площади, ограниченной кривой ММР,
равна Mω , а абсцисса центра тяжести площади, ограниченной
кривой МЧР, равна Mn (см. рис.2). Кривые распределения могут
иметь один (унимодальные), два (бимодальные) или несколько максимумов (полимодальные).
При одинаковой средней ММ полимеры могут иметь различное ММР – узкое (на рис. 3, кривая 2) и широкое (рис. 3, кривая 1).
Рис. 1. Кривые интегрального (2) и дифференциального (1) массового ММР полимера.
Здесь ∆ m / m0 – относительная интегральная доля
фракций, а (1/ m0)(d m/d M)
– массовая доля фракций.
Рис. 2. Дифференциальные кривые МЧР (1) и ММР(2).
17

Рис. 3. Кривые ММР с различной полидисперсностью и одинаковым значением средней ММ.
Фракционирование полимеров
Фракционирование позволяет разделять образцы полимеров на фракции с различными ММ и используется для построения кривых ММР. Различают два типа фракционирования: препаративное и аналитическое. При препаративном фракционировании выделяют отдельные фракции и изучают их свойства. При аналитическом фракционировании кривую распределения получают без выделения отдельных фракций. К аналитическим методам фракционирования относят ультрацентрифугирование, турбодиметрическое титрование, гель-проникающую хроматографию.
К препаративным методам фракционирования относятся
фракционное растворение и фракционное осаждение. Эти мето-
ды основаны на зависимости растворимости полимера от ММ – с увеличением ММ растворимость полимера уменьшается. Метод фракционного осаждения заключается в последовательном осаждении из раствора полимера фракций, ММ которых убывает. Осаждение фракций вызывают различными способами:
•добавлением осадителя к раствору полимера,
•испарением растворителя из раствора полимера,
•изменением температуры раствора, которое ухудшает качество растворителя.
18
Метод фракционного растворения заключается в последовательном экстрагировании полимера рядом жидкостей с возрастающей растворяющей способностью. При этом выделяемые фракции имеют последовательно возрастающую ММ.
Построение кривых распределения по ММ В результате фракционирования выделяют ряд фракций. Для
каждой фракции определяют массу и находят ММ. Экспериментальные данные вносят в таблицу 7.
Таблица 7.
Данные для построения интегральной и дифференциальной кривых ММР
№ |
ММ |
Масса |
Массовая |
Интеграль- |
Диффе- |
фракций |
|
фрак- |
доля фрак- |
ная массо- |
ренциаль- |
|
|
ций |
ций |
вая доля |
ная массо- |
|
|
|
|
фракций |
вая доля |
|
|
|
|
|
фракций |
1 |
M1 |
m1 |
ω1=m1 / Σmi |
W1 = ω1 |
d W1 / d M1 |
2 |
M2 |
m2 |
ω2=m2 / Σmi |
W2= ω1+ ω2 |
d W2 / d M2 |
. |
. |
. |
|
. |
. |
. |
. |
. |
. |
. |
|
i |
Mi |
mi |
ωi=mi / Σmi |
Wi= Σ ωi |
d Wi / d Mi |
|
|
|
|
|
|
Затем определяют массовую долю каждой фракции ωi и далее определяют интегральную массовую долю фракций суммированием всех долей фракций, начиная с наименьшей по ММ фракции.Расчётные данные вносят в табл. 7.
По данным табл. 7 строят интегральную кривую ММР в координатах Wi=f(ММ) и дифференциальную кривую ММР в координатах dWi/dMi=f(ММ).
19
Молекулярные характеристики олигомеров
Олигомеры характеризуют, как и полимеры, средними значениями ММ, интегральными и дифференциальными функциями числового и массового распределения и показателем полидисперсности. Однако в отличие от полимеров на свойства олигомеров существенное влияние оказывают функциональные группы, их концентрация в полимере и характер распределения в макромолекулах. Поэтому для олигомеров используются дополнительные характеристики:
•Распределение по типам функциональных групп, которое может быть представлено в виде интегральных и дифференциальных числовой и массовой функций.
•Среднечисловая (fn) и среднемассовая (fω) функциональ-
ность.
N |
N |
fn= ∑ fi xi |
и fω= ∑ fi ωi |
I =1 |
I =1 |
•Степень неоднородности по функциональным группам определяется отношением fω / fn.
•Эквивалентная молекулярная масса – ММ, приходящая-
ся на одну функциональную группу MЭ = (МФ /СФ) 100, где МФ и СФ – соответственно молекулярная масса и концентрация функциональной группы.
Многие химические и физические свойства полимеров зависят от характера ММР. Так, высокомолекулярные фракции придают высокую прочность и твердость полимерам, но затрудняют их переработку, а низкомолекулярные фракции ухудшают механические свойства полимеров, но улучшают их технологические свойства (повышают растворимость, снижают вязкость и облегчают переработку). Поэтому в зависимости от требований, предъявляемых к полимерным материалам и изделиям, ММ и ММР можно варьировать путём изменения условий получения полимеров и проведением направленной деструкции готовых полимеров.
20
