
- •Розрахунковий варіант
- •Робоче завдання
- •Робоче тіло – ідеальний газ.
- •Маса ідеального газу.
- •Визначення параметрів стану в початковій точці циклу
- •Визначимо основні параметри станів по графікам процесів
- •Визначимо параметри стану в точці 2
- •Визначимо параметри стану в точці 3
- •Визначимо параметри стану в точці 4
- •Визначимо параметри стану в точці 5
- •Зображення циклу ідеального газу pv- I Ts- діаграмах
- •Розрахунок процесів, що входять до циклу
- •Процес 1-2
- •Процес 2-3
- •Процес 3-4
- •Процес 4-5
- •Процес 5-1
- •Розрахунок циклу за іі законом термодинаміки
- •Робоче тіло – реальний газ (н2о)
- •Маса водяної пари
- •Параметри стану водяної пари у початковій точці 1
- •Параметри водяної пари в точці 2
- •Параметри водяної пари в точці 3
- •Параметри водяної пари в точці 4
- •Параметри водяної пари в точці 5
- •Розрахунок процесів водяної пари
- •Процес 1-2
- •Процес 2-3
- •Процес 3-4
- •Процес 4-5
- •Процес 5-1
- •Аналіз циклу водяної пари за іі законом термодинаміки
Процес 2-3
Далі йде процес 2-3 – процес ізотермічного розширення. Для цього ізотермічного процесу простежується різниця властивостей ідеального газу та водяної пари. Для водяної пари U=ƒ(T,p) і H=φ(T,p), тобто ∆U та ∆H не будуть мати нульового значення:
∆U2-3 = m·(u3 – u2) = 3·(3016.2 – 2887.5) = 386.1 кДж
∆H2-3 = m·(h3 – h2) = 3·(3348 - 3306) = 126 кДж
Зміна ентропії в процесі 2-3 відмінна від нуля
∆S2-3= m·(s3 – s2) = 3·(8.263 – 6.925) = 4.014 кДж/К
За формулою
![]() розрахуємо
кількість теплоти, що відводиться у
процесі
розрахуємо
кількість теплоти, що відводиться у
процесі
![]() кДж
кДж
Згідно І закону термодинаміки
Q = ∆U + L → L2-3=Q - ∆U2-3= 2447.784 кДж
Q = ∆H + Lн → Lн2-3=Q - ∆Н2-3=2707.882 кДж
 На
основі останніх рівнянь складемо схему
енергобалансу.
На
основі останніх рівнянь складемо схему
енергобалансу.
Зобразимо процес 2-3 у hs-, Ts-, i pv- координатах.
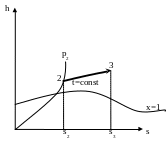


Занесемо отримані дані в таблицю 4.
Процес 3-4
Далі йде процес 3-4 – процес ізохоричного відведення теплоти. Здійснимо розрахунок процесу 3-4 подібно до попередніх.
∆U3-4 = m·(u4 – u3) = 3·(2842 - 3016.2) = -522.6 кДж
∆H3-4 = m·(h4 – h3) = 3·(3122 - 3348) = -678 кДж
∆S3-4= m·(s4 – s3) = 3·(8 - 8.263) = -0.789 кДж/К
Особливістю процесу, що
протікає при сталому об’ємі, є те, що
робота зміни об’єму дорівнює нулю.
Враховуючи це, за І законом термодинаміки
визначимо теплоту процесу:
![]() , Q3-4
= ∆U3-4
+ L3-4 →
Q3-4
= ∆U3-4
= -522.6 кДж
, Q3-4
= ∆U3-4
+ L3-4 →
Q3-4
= ∆U3-4
= -522.6 кДж
Наявну роботу визначимо із загальної формули:
![]() кДж
кДж
Побудуємо схему енергобалансу ізохоричного процесу.

Зобразимо процес 3-4 у hs-, Ts-, i pv- координатах.



Занесемо отримані дані в таблицю 4.
Процес 4-5
Наступним процесом циклу є процес ізобарного стиснення 4-5. По аналогії обрахуємо ∆U4-5, ∆H4-5,∆S4-5 :
∆U4-5 = m·(u5 – u4) = 3·(2614 - 2842) = -684 кДж
∆H4-5 = m·(h5 – h4) = 3·(2820 - 3122) = -906 кДж
∆S4-5= m·(s5 – s4) = 3·(7.415 - 8) = -1.755 кДж/К
Особливістю ізобарного
процесу є те, що наявна робота процесу
має нульове значення. Роботу зміни
об’єму знайдемо, використовуючи загальну
формулу:
![]() ,
якщо p=const,
то:
,
якщо p=const,
то:
![]() кДж
кДж
Теплоту ізобарного процесу найпростіше обчислити за І законом термодинаміки:
![]() , то Q4-5
= ∆Н4-5
+ Lн4-5
→ Q4-5
= ∆Н4-5
= -906 кДж
, то Q4-5
= ∆Н4-5
+ Lн4-5
→ Q4-5
= ∆Н4-5
= -906 кДж
Схема енергобалансу ізобарного процесу водяної пари нагадує схему енергобалансу ідеального газу.

При зображенні процесу 4-5 кінцева точка 5 визначається на перетині ізобари p5 і s5. Знаючи напрям ізобарного процесу, точку 4 знайдемо на перетині лінії процесу з об’ємом v4. Покажемо цей процес у термодинамічних діаграмах.



Занесемо отримані дані в таблицю 4.
Процес 5-1
Ізотерма 5-1 – процес стиснення водяної пари. Здійснимо розрахунок процесу 5-1.
∆U5-1 = m·(u1 – u5) = 3·(2610 - 2614) = -12 кДж
∆H5-1= m·(h1 – h5) = 3·(2810 - 2820) = -30 кДж
Обчислимо зміну ентропії в цьому процесі. Вона буде від’ємною.
∆S5-1= m·(s1 – s5) = 3·(6.925 - 7.415) = -1.47 кДж/К
Розрахуємо кількість теплоти, що відводиться в процесі:
![]() кДж
кДж
Згідно І закону термодинаміки
Q = ∆U + L → L 5-1=Q - ∆U 5-1= -646.56 кДж
Q = ∆H + Lн → Lн 5-1=Q - ∆Н 5-1=-628,56 кДж
Побудуємо схему енергобалансу ізотермічного процесу.

Зобразимо процес 5-1 у hs-, Ts-, i pv- координатах.



Занесемо отримані дані в таблицю 4.
Дані таблиці 4 свідчать про те, що незалежно від природи робочого тіла властивості параметрів стану та характеристики процесів зберігаються:
∆Uц = 0, ∆Нц = 0, ∆Sц = 0, Qц ≈ Lц ≈ Lнц
