
Kristalografiya
.pdf
1
«Кристалографія, кристалохімія та мінералогія»
1.Монокристали та полікристали.
2.Визначення твердості мінералів за шкалою Мооса.
3.Прості форми кристалів.
4.Класифікація кристалічних речовин за зв’язком між атомами та структурою.
5.Аморфні та кристалічні тверді тіла, їх фізичні властивості.
6.Ізотропія та анізотропія кристалів.
7.Опрерації симетрії в кристалах. Формули симетрії. Навести приклад.
8.Точкові групи. Приклад виведення точкової групи.
9.Просторові групи симетрії кристалічної решітки. Порядок запису символів просторової групи. Приклади.
10.Сингонії та категорії кристалів. Визначальні елементи симетрії в сингоніях. 11.Стереографічна проекція кристалів.
12.Гномостереографічна проекція кристалів.
13.Індекси вузлів атомів, індекси напрямів у кристалі, індекси площин кристалів. 14.Елементарна комірка кристалічного твердого тіла та її базис.
15.Типи решіток Браве та їх характеристики.
16.Обернена гратка та її властивості.
1. Монокристали та полікристали.
Кристалічні тіла ділять на дві групи: монокристали й полікристали Монокристали – тверді тіла, частинки яких утворюють єдину кристалічну решітку. Зовнішня форма монокристалів одного виду може бути різною, але кути між відповідними гранями постійні – закон постійності кутів. Монокристалами є більшість мінералів. Крупні природні монокристали зустрічаються рідко (наприклад, лід, сіль, ісландський шпат). Багато монокристалів вирощують штучно.
Характерною особливістю монокристалів є анізотропія – залежність фізичних властивостей – пружних, механічних, теплових, електричних, магнітних, оптичних – від напряму. Це пояснюється тим, що густина розташування
частинок кристалічної решітки в різних напрямках не є однаковою (рис. 6.7), що й приводить до відмінності
властивостей кристалів уздовж цих напрямків. Тверді тіла, що мають дрібнокристалічну структуру,
тобто що складаються з безлічі довільно орієнтованих кристалічних зерен (наприклад, гірські породи, метали, сплави), називають полікристалами. У полікристалах анізотропія спостерігається тільки для окремих дрібних кристалів, але їх різна орієнтація призводить до того, що властивості полікристала по
всіх напрямках в середньому однакові.
2
2. Визначення твердості мінералів за шкалою Мооса.
Шкала твердості по Моосу − десятибальна шкала мінеральної твердості, стійкості до подряпин більш м'яких матеріалів перед більш жорсткими. Твердість окремих мінералів не є пропорційною і не змінюється лінійно, але має порівняльні характеристики. Мінерали у шкалі розташовані від самого м'якого до самого твердого. Кожен мінерал може подряпати мінерал, який передує йому за шкалою (м'якший) і може бути подряпаний наступним після нього за шкалою (більше твердим). Це тільки приблизна шкала, класифікація мінералу, який зможе подряпати поверхню іншого мінералу, відповідного до його твердості. Наприклад, якщо подряпати поверхню мінерального кварцу, то матеріал, що дряпає, може мати таку ж твердість. Якщо випробуваний мінерал зможе подряпати кварц і не зможе подряпати сам себе, тоді твердість зразка вважається щонайменше 7,5.
Твердість мінералів має анізотропію, тобто вона може бути різною в різних напрямках, наприклад: мінеральна твердість кіаніту – уздовж найбільшої кристалографічної вісі має твердість по Моосу приблизно 3,5 і перпендикулярно до цієї вісі твердість збільшується приблизно до 7.
Мінералогічна шкала твердості (шкала Мооса)
Еталонний |
Твердість |
Оброблюваність |
Інші мінерали з аналогічною |
|
мінерал |
твердістю |
|||
|
|
|||
Тальк |
1 |
Дряпається нігтем |
Графіт |
|
Гіпс |
2 |
Дряпається нігтем |
Хлорит, галіт |
|
Кальцит |
3 |
Дряпається ножом |
Біотит, золото, срібло |
|
Біотит, золото, |
4 |
Дряпається ножом |
Доломіт, сфалерит |
|
срібло |
||||
|
|
|
||
Апатит |
5 |
Дряпається ножом |
Гематит, лазурит |
|
Ортоклаз |
6 |
Дряпається напильником |
Опал, рутил |
|
Кварц |
7 |
Піддається обробці алмазом, |
Гранат, турмалін |
|
дряпає скло |
||||
|
|
|
||
Топаз |
8 |
Піддається обробці алмазом, |
Берил, шпінель |
|
дряпає скло |
||||
|
|
|
||
Корунд |
9 |
Піддається обробці алмазом, |
- |
|
дряпає скло |
||||
|
|
|
||
Алмаз |
10 |
Ріже скло |
- |
3.Прості форми кристалів.
Видеальных условиях кристаллы образуются в виде многогранников с различным количеством граней. По внешнему виду они делятся на две группы:
- ограненные одинаковыми по форме и размеру гранями; - ограненные различными по форме и размеру гранями.
3
Кристаллы первой группы называются простыми формами, кристаллы второй - комбинациями.
Простой формой называется совокупность одинаковых по внешней форме и размеру граней, связанных между собой элементами симметрии и обладающих идентичными структурными особенностями и физико-химическими свойствами.
Среди простых форм различают открытые и закрытые.
Открытые формы характеризуются тем, что их грани не закрывают пространство со всех сторон; закрытые - полностью закрывают.
Простая форма, грани которой размещаются наклонно относительно всех осей и плоскостей симметрии, называется общей. Простая форма, грани которой размещаются перпендикулярно (или параллельно) хотя бы к одной оси симметрии, называется частной формой.
На реальных кристаллах установлено 47 основных простых форм, причем каждой сингонии и каждому виду симметрии свойственна своя группа простых форм с определенным комплексом элементов симметрии.
4. Класифікація кристалічних речовин за зв’язком між атомами та структурою.
Тип зв'язку між елементарними частинками в твердому тілі (кристалі) визначається електронною будовою атомів, які взаємодіють. Найважливіші зв'язки: іонний, ковалентний і металевий. Тип зв'язку істотно впливає на властивості матеріалу.
Іонний зв'язок виникає між різнорідними атомами, наприклад натрію і хлору, один з яких віддає свій валентний електрон і перетворюється у позитивно заряджений іон (Nа + ), а інший приймає електрон і стає негативно зарядженим іоном (Сl - ). Отже, іонний зв'язок обумовлюється електростатичною взаємодією протилежно заряджених іонів. Такий зв'язок типовий для неорганічних сполук. У більшості випадків іонні кристали – діелектрики.
Ковалентний зв'язок створюється за рахунок об'єднання валентних електронів сусідніх атомів у одному енергетичному рівні (зовнішній орбіті). Об'єднані електрони належать водночас обом атомам і перебувають на спільній орбіті. Ці електрони мають протилежно скеровані спіни і взаємодіють як два електромагніти. Ковалентний зв'язок утворюють як однорідні атоми (кремній, вуглець в кристалічній ґратці алмазу), так і різнорідні (залізо - вуглець у хімічній сполуці Fе3С, алюміній - азот у хімічній сполуці AlN). Ковалентний зв'язок дуже 4 міцний. Багато кристалів з таким зв'язком відзначаються високою температурою плавлення, значною твердістю (карбіди, нітриди) і суттєвою зносостійкістю.
Металевий зв'язок реалізується за рахунок електростатичної взаємодії між позитивно зарядженими іонами та негативно зарядженими вільними електронами. Валентні електрони атомів металу порівняно легко втрачають зв'язок зі своїми ядрами, утворюючи так званий електронний газ. Металевий зв'язок не скерований в одному напрямку. Добра електро- і теплопровідність металів забезпечується вільними
4
електронами. Існування водночас нейтральних й іонізованих атомів та вільних електронів є основою уявлень щодо особливого типу міжатомного зв'язку, притаманного тільки металам, - металевого. У металі постійно відбувається обмін електронами між нейтральними та іонізованими атомами, завжди є певна кількість електронів, що на даний момент не належать якомусь з атомів. Якщо створити у металі різницю потенціалів, рух електронів набуде певного напрямку і виникне електричний струм. Наявністю вільних (колективізованих) електронів пояснюють існування спільних для всіх металів властивостей (пластичність, непрозорість, блиск, високі електро- і теплопровідність), а їх кількістю - різний ступінь "металевості" окремих металів.
Під структурою кристала (кристалічною структурою) розуміють конкретне просторове розташування матеріальних частинок (атомів, іонів, молекул і їхніх груп), що його утворюють. Ці частинки називають також структурними частинками. У кристалічній структурі положення частинок збігаються з вузлами ґратки, яка її відображає, або частинки розташовуються навколо вузлів симетричними групами.
Класифікацію структур за залежністю будови від хімічного складу речовини. Це так звана стехіометрична класифікація структур. За даною систематикою кристалічні структури зібрано в такі групи:
1.А-елементи;
2.В-сполуки типу АВ (наприклад, NaCl, CsCl);
3.С-сполуки типу ( , ) AB2 CaF2 TiO2 ;
4.D-сполуки типу ( ) AnB m Al2O3 ;
5.Е-сполуки, що складаються більше ніж із двох сортів атомів без радикалів або комплексних іонів ( , ) CuFeS2 PbFCl ;
6.F-сполуки з двохчи триатомними іонами ( , ) NaHF2 KCNS ;
7.G-сполуки з чотириатомними іонами ( , ) CaCO3 NaClO3 ;
8.Н-сполуки з п’ятиатомними іонами ( , 5 ) CaSO4 CaSO4 H2O ;
9.L-сплави;
10.S-силікати.
Часто сполуки однієї стехіометрії (наприклад, АВ) утворюють різні структури. Тому кожна з 10 структурних (стехіометричних) груп містить низку нумерованих структурних типів (наприклад: В1, .. В12; С1,.. С19). Деякі структурні типи поділяють на підтипи, що відображає нижній малий цифровий індекс (наприклад: 3 12 DO ; L ). Отже, кожна кристалічна структура має символ. Він складається з великої латинської літери (структурна група), великої цифри (структурний тип) та може мати малий цифровий індекс (підтип).
5. Аморфні та кристалічні тверді тіла, їх фізичні властивості.
Як відомо матерія може перебувати у трьох агрегатних станах: газоподібному, рідкому та твердому, які відрізняються різними ступенями тяжіння атомами водню.
В газах матеріальні частинки знаходяться у постійному русі.
Твердий стан характеризується розташуванням атомів чи молекул: кристалічних чи аморфних. У твердих тілах вони заморожені, хаотично чи закономірно розташовані частинки.

5
Рідкий стан – перехідний між газоподібною та твердою формою, між ними існують рідкі кристали – органічні сполуки, молекули яких мають тенденцію до упорядкованого розташування в просторі.
Аморфні тіла є ізотропними. Аморфні тіла, наприклад скло, являють собою переохолоджені рідини і не є істинно твердими тілами. Взаємне розташування структурних одиниць тут характеризується наявністю порядку тільки у взаємному розташуванні найближчих сусідів — так називаним ближнім порядком, у той час як тверді тіла — кристали — володіють, крім того, також далеким порядком, тобто строгою періодичністю в розташуванні часток, що складають кристали. Ізотропія тіла росте в усі сторони з однаковою швидкістю. У природі такі тіла зустрічаються дуже рідко. Це Опал(SiO2 * nH2O) або Алюмогель(Al2O3 * nH2O).
Кристалічні тверді тіла зустрічаються частіше і на відміну від аморфних їх називають анізотропними. Анізотропія чітко проявляється в умовах вільного росту кристалів в наслідок залежності швидкості росту від напрямку.
Кристал від грецького – лід. Кристал - однорідне анізотропне тіло що здатне самоогранятися.
Анізотропія означає що фізичні та хімічні властивості різні в різних напрямках. Але однакові в паралельних напрямках.
6. Ізотропія та анізотропія кристалів.
Аморфні тіла є ізотропними. Ізотропія тіла росте в усі сторони з однаковою швидкістю
– здатність мати однакові властивості в різних напрямках.
Наступна особливість кристалів є анізотропія, тобто здатність різні властивості у різних напрямках.
Анізотропія є загальна властивість кристалів, властивості можуть бути векторні та скалярні. Твердість і спальністьвекторні властивості, питома маса, питома теплова - незалежні скалярні величини. В деяких випадках властивості в протилежних напрямках однакові – ці властивості бі-екваторіаль і називаються тензорами, а в протилежних напрямках властивості кристалів різні то мова йде моно векторіальні або полярність кристалів.
Деякі фізичні властивості характеризуються тензором другого(2) рангу до них відноситься теплове розширення , магнітне сприятливість, діелектрична стала, Електро та тепло провідність а також коефіцієнт дифузії.
П’єзоелектричні властивості характеризуються тензором третього(3) рангу, а пружні властивості – тензором четвертого(4) рангу.
За зовнішньою формою 32 вида (макроскопічна форма), які обмежені гранями
однаковою формою і розміром. |
|
Приклади: проста форма - |
|
NaCl |
SiO2 |
Комбінована форма кристалів, яка складається з двох простих (4 квадрат гранями і 3 трикутника - PbSO2)
Грані ребер та вершини різноманітних фігур є елементи їх огранення.
6
Між гранями, вершинами і ребрами існує певна залежність.
Грані + вершини = ребра + 2 елементи
симетрії кристалів
Закон Ейлера -Декарта
Куб: 6+8 =12+2; 14 = 14.
Характерною рисою кристалів є анізотропія властивостей: їхні векторні властивості в будь-якій внутрішній крапці в однакових (рівнобіжних), а також у симетричних напрямках однакові; у різних напрямках вони різні.
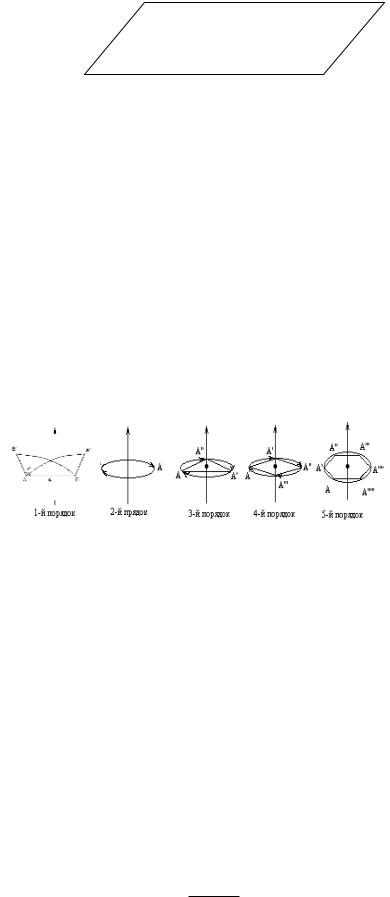
7. Операції симетрії в кристалах. Формули симетрії.
Операції симетрії в кристалах
Вісі обертання.
Якщо тіло при обертанні на 3600 суміщується із собою, то воно має вісь обертання 1-го порядку (вісі першого порядку є в будь якого тіла) і так далі:
A’B’ – na = a + 2aCos(180 - ) = a + 2Cos = |
=a(1+2Cos ) |
|
||||||||
N = 1 2Cos ; Cos = |
n 1 |
|
= |
N . |
|
|
|
|||
|
|
|
|
|||||||
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
N |
Cos |
|
|
|
|
Назва вісі |
Цифрове |
||
|
|
|
|
|
|
|
|
|
|
позначення |
|
0 |
0 |
|
|
|
|
900 |
|
Четверна |
4 |
|
-1 |
-0,5 |
|
|
|
1200 |
|
Потрійна |
3 |
|
|
+1 |
0,5 |
|
|
|
600 |
|
Шести |
6 |
|
|
-2 |
-1 |
|
|
|
|
1800 |
|
Подвійна |
2 |
|
+2 |
+1 |
|
|
|
3600 |
|
Одинарна |
1 |
|
|
|
|
|
|
|
Елементи симетрії: |
|
|||
1)Прості елементи – С Р 1 2 3 4 6
2)Складені елементи – інверсійна вісь, яка комбінується з центром симетрії
3)Складні - 1,2,3,4,6 Li1=C, Li2 =P,Li3 = L3 + Li1,Li4 ,Li6 = L3 + P
7
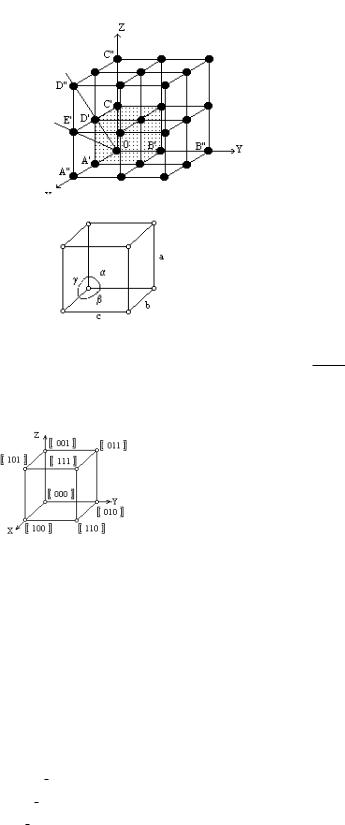
В макроскопічному плані ми розглядаємо як суцільне середовище. Правильне розташування граней і таке інше навело на думку про існування просторової решітки на мікроскопічному рівні.
Мінімальна відстань між двома атомами в заданому
напрямку називається періодом ідентичності. Як правило координаційні вісі вибираються в напрямках з мінімальним періодом ідентичності і ці напрямки називаються головними. Мінімальна відстань між атомами на головних вісях є періодом решітки.
Розглянемо елементарний паралелепіпед, який можна транслювати на всі напрямки і одержати ту ж саму решітку. Елементарну комірку можна задати трьома величинами або 6 скалярними величинами – a, b, c
Формули симетрії.
У кристалографії будь-яка точка описується кристалографічною системою координат:
(x, y, z) x = ma, y = nb, z = pc,
де m,n,p – кристалографічні координати; a, b, c – періоди кристалографічної решітки: [[ m n p ]].
Позначення вузлових прямих в кристалі.
В кристалі будь-які паралельні прямі вважаються ідентичними. Важливо задати напрямок цієї прямої. Цей напрямок за допомогою вузла, який розташований на мінімальній відстані.
Клас кристалографічних напрямків.
Це сукупність симетричних перетворень
[100]<100> - 6 куб
[010]<111> - 8 октаедр
[001] <110> - 12 додекаедр [001] [010] [100]
8. Точкові групи. Приклад виведення точкової групи. Кристалографічні класи (точкові групи).
Кристалічні класи Класами симетрії кристалічних многогранників називається повна сукупність
елементів симетрії. Позначення елементів симетрії деяких кристалічних многогранників і деяких їх сполук.
|
По Флінту |
Міжнародна |
По Шелфісу |
Обертова вісь n-ого порядку |
Ln |
N(1, 2, 3, 4, 6) |
Cn |
Площина симетрії |
P |
m |
Cs |
Центр симетрії |
C |
i=1 |
Ci |
8
Обертова(дзеркальна) вісь |
- |
- |
Sn |
Сукупність одиничної вісі n-ого |
Ln+nL2 |
- |
Dn(D2=V) |
порядку та перпендикулярна до неї |
|
|
|
осей другого порядку |
|
|
|
Сукупність вісі n-ого порядку та |
Ln+P |
m/m |
Cnh |
площини перпендикулярної до неї |
|
|
|
Сукупність вісі n-ого порядку та |
Ln+nP |
nm |
Cnv |
площини паралельної до неї |
|
|
|
Наявність площини, що ділить кути |
- |
- |
D |
між L2 навпіл |
|
|
|
Символи для позначення |
- |
- |
T, Tn, Ta |
тетраедричних класів кубічної |
|
|
|
сингонії |
|
|
|
|
|
|
|
Символи для позначення октаедри |
- |
- |
0, 0h |
чних класів кубічної сингонії |
|
|
|
|
|
|
|
Сукупність обертових осей n-ого |
Ln+П+2P |
n/mnm |
- |
порядку перпендикулярних площині |
|
|
|
P та двох --паралельних площині 2P |
|
|
|
|
|
|
|
Три перпендикулярних площини |
- |
mmm |
- |
симетрії |
|
|
|
|
|
|
|
Три перпендикулярних вісі другого |
3L2 |
222 |
- |
порядку |
|
|
|
|
|
|
|
Наявність двох елементів симетрії породжує третій рівнодіючий елемент дія якого дорівнює сумі дій двох перших . Сполучення елементів описуються п’ятьма теоремами або додавання симетричних операцій.
При виводі класів симетрії всіх сингоній крім кубічної вводять поняття одиничного напрямку. Це той напрямок в кристалі, який не повторюється. В ромбічній системі три одиничних напрямки.
9. Просторові групи симетрії кристалічної решітки. Порядок запису символів просторової групи. Приклади.
Просторова група симетрії – сукупність усіх можливих елементів симетрії кристалічної структури, так само характеризує симетрії кристалічної структури, як точкова група симетрії характеризує симетрію зовнішньої форми кристала та його фізичні властивості.
Просторова група характеризується числом симетрично еквівалентних позицій (точок).
Вибравши точку в середині елементарної комірки і розмноживши її усіма елементами просторової групи одержимо правильну систему точок, яка (буває загальною, окремою (індивідуальною)).
Загальна правильна система точок, не лежить на елементах симетрії, а окремо (індивідуально) знаходиться на елементах симетрії.

Загальна правильна система точок має три ступені свободи ( не пов’язана з елементами симетрії ).
Кратністю правильної системи точок – називається число точок в елементарній комірці, симетрично еквівалентних одна одній. Кратність загальної правильної системи точок аналогічна числу граней простої форми. Кратність вища, ніж для окремої (індивідуальної) в правильній системі точок.
Приклади запису просторових груп
структура |
Просторова група |
|
|
|
|
|
|
|
Кристалографічний клас |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(точкова група) |
|
Короткий |
Повний символ |
|||||||||||||
|
|
||||||||||||||
|
символ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu,NaCl |
Fm3m |
4 |
|
2 |
|
m3m |
|||||||||
|
|
F |
|
|
|
3 |
|
|
|
|
|
||||
|
|
m |
m |
|
|||||||||||
W, Fe |
Im3m |
4 |
|
|
2 |
|
|
|
m3m |
||||||
|
|
I |
|
|
|
|
3 |
|
|
|
|
|
|||
|
|
m |
m |
|
|||||||||||
C (алмаз) |
Fd3m |
4 |
|
2 |
|
|
|
m3m |
|||||||
|
|
F |
|
|
3 |
|
|
|
|||||||
|
|
d |
|
m |
|
||||||||||
Mg,графіт |
P63/mmc |
P63/m2/m2/c |
6/mmm |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10. Сингонії та категорії кристалів. Визначальні елементи симетрії в сингоніях.
Сингонії та категорії кристалів.
Елементарну комірку можна задати трьома величинами a,b,c або 6 скалярними величинами –  Систематизація кристалів.
Систематизація кристалів.
Сингонія |
Співвідношення |
|
Визначений |
|
|
періодів |
Коорд. кутів |
елемент симетрії |
|
Кубічна |
a b c |
90 |
4L3 |
|
Тетрагональна |
a b c |
90 |
L4 – Li4 |
|
Гексагональна |
a b c |
90 , 120 |
L6 |
– Li6 |
Ромбічна |
a b c |
90 |
3L2 - 3Li2 |
|
Ромбоедрична |
a b c |
90 |
L3 |
- Li3 |
Моноклінна |
a b c |
90 , 90 |
L2 |
– Li2 |
Триклинна |
a b c |
90 |
L1 |
– Li1 |
У кристалографії будь-яка точка описується кристалографічною системою координат:
(x, y, z) x = ma, y = nb, z = pc,

10
де m,n,p – кристалографічні координати;a, b, c – періоди кристалографічної решітки: [[ m n p ]].Позначення вузлових прямих в кристалі.В кристалі будь-які паралельні прямі вважаються ідентичними. Важливо задати напрямок цієї прямої. Цей напрямок за допомогою вузла, який розташований на мінімальній відстані.
Клас кристалографічних напрямків.
Це сукупність симетричних перетворень
[100]<100> - 6 куб
[010]<111> - 8 октаедр
[001] <110> - 12 додекаедр [001] [010] [100]
Розташування 32 кристалічних класів по сингоніям та їх позначення.Симетрія структури кристалів. (Дисконтінум)
Визначальні елементи симетрії в сингоніях
Елементи симетрії:
1)Прості елементи – С Р 1 2 3 4 6
2)Складені елементи – інверсійна вісь, яка комбінується з центром симетрії
Складні - 1,2,3,4,6 Li1=C, Li2 =P,Li3 = L3 + Li1,Li4 ,Li6 = L3 + P
11. Стереографічна проекція кристалів.
