
- •Розрахунковий варіант
- •Робоче завдання
- •Робоче тіло – ідеальний газ.
- •Маса ідеального газу.
- •Визначення параметрів стану в початковій точці циклу
- •Визначимо основні параметри станів по графікам процесів
- •Визначимо параметри стану в точці 2
- •Визначимо параметри стану в точці 3
- •Визначимо параметри стану в точці 4
- •Визначимо параметри стану в точці 5
- •Зображення циклу ідеального газу pv- I Ts- діаграмах
- •Розрахунок процесів, що входять до циклу
- •Процес 1-2
- •Процес 2-3
- •Процес 3-4
- •Процес 4-5
- •Процес 5-1
- •Розрахунок циклу за іі законом термодинаміки
- •Робоче тіло – реальний газ (н2о)
- •Маса водяної пари
- •Параметри стану водяної пари у початковій точці 1
- •Параметри водяної пари в точці 2
- •Параметри водяної пари в точці 3
- •Параметри водяної пари в точці 4
- •Параметри водяної пари в точці 5
- •Розрахунок процесів водяної пари
- •Процес 1-2
- •Процес 2-3
- •Процес 3-4
- •Процес 4-5
- •Процес 5-1
- •Аналіз циклу водяної пари за іі законом термодинаміки
Параметри водяної пари в точці 2
Початкову точку ізотермічного
процесу 2-3 знайдемо на перетині адіабати
s=6.925
кДж/(  кг
·K) та ізобари
p2=44.42бар.
Точка 2 знаходиться у зоні перегрітої
пари.
кг
·K) та ізобари
p2=44.42бар.
Точка 2 знаходиться у зоні перегрітої
пари.
Знайдемо v1, h1, s1 за hs- діаграмою, як показано штриховими лініями:
v2=0.093 м3/кг , t2=433ºC, h2=3306 кДж/кг, s2= s1=6.925 кДж/(кг·К).
Внутрішню енергію розрахуємо:
u2 = h2 – p2v2=3306 - 4500·0.093 = 2887.5 кДж/кг
Параметри точки 2 запишемо в таблицю 3.

Параметри водяної пари в точці 3
Тепер розглянемо, що є для знаходження на hs- діаграмі точки 3. За умовою 2-3 – ізотерма і V3=4.2 м3, а отже питомий об’єм:
v3=V3/m=4.2/3=1.4 м3
Далі знайдемо точку 3 на перетині ізотерми t=433ºC та ізохори v3=1.4 м3/кг
Графічно визначимо t3, h3, s3, p3 за hs- діаграмою, як показано штриховими лініями:
p3=2.34бар , t3=433ºC, h3=3348 кДж/кг, s3=8.263 кДж/(кг·К).
Внутрішню енергію розрахуємо:
u3 = h3 – p3v3=3348- 237·1.4 = 3016.2 кДж/кг
Параметри точки 3 запишемо в таблицю 3.

Параметри водяної пари в точці 4
Тепер розглянемо, що є для знаходження на hs- діаграмі точки 4. Процес 3-4 – ізохоричний і згідно умов завдання p4=p1/2.5=2·105 (Па)
Далі знайдемо точку 4 на перетині ізобари p4=1.97бар та ізохори v4=1.4 м3/кг
Графічно визначимо t4, h4, s4 за hs- діаграмою, як показано штриховими лініями:
t4=320ºC, h4=3122 кДж/кг, s4=8 кДж/(кг·К).
Внутрішню енергію розрахуємо:
u4 = h4 – p4v4=3122 - 200·1.4 = 2842 кДж/кг
Параметри точки 4 запишемо в таблицю 3.


h4
s4
Параметри водяної пари в точці 5
Точка 5 знаходиться на перетині ізотерми 5-1 та ізобари 5-4, де ізотерма t1=175ºC, а p4=1.97бар.
Графічно визначимо h5, s5,v5 за hs- діаграмою, як показано штриховими лініями:
v5=1.03 м3/кг, h5=2820 кДж/кг, s4=7.415 кДж/(кг·К).
Внутрішню енергію розрахуємо:
u5 = h5 – p5v5=2820 - 200·1.03 = 2614 кДж/кг
П
h


5
Розрахунок процесів водяної пари
Усі процеси, що складають цикл, зображені при визначенні параметрів останньої точки циклу. Розрахунок кожного процесу будемо вести у такій послідовності. По-перше, знайдемо ∆U, ∆H, ∆S у процесі; по-друге, розрахуємо Q, L, Lн; по-третє, складемо енергетичний баланс процесу за І законом термодинаміки, покажемо схему енергобалансу; по-четверте, накреслимо процес у hs-, Ts-, i pv- діаграмах водяної пари.
Процес 1-2
По аналогії з ідеальним газом першим йде процес 1-2. Для цього адіабатного процесу простежується різниця властивостей ідеального газу та водяної пари. У процесі 1-2 ідеального газу зміна ентропії рівна нулю. Внутрішня енергія газу і ентальпія залежать тільки від температури. Для водяної пари U=ƒ(T,p) і H=φ(T,p), тобто ∆U та ∆H не будуть мати нульового значення:
∆U1-2 = m·(u2 - u1) = 3·(2887.5 – 2610) = 832.5 кДж
∆H1-2 = m·(h2 – h1) = 3·(3306 – 2810) = 1488 кДж
Зміна ентропії в процесі 1-2 рівна нулю (∆S1-2=0).
Знайдемо характеристики процесу. Незважаючи на природу робочого тіла, у адіабатному процесі, що йде без теплообміну з навколишнім середовищем, теплота дорівнює нулю. Але при розрахунку роботи зміни об’єму та наявної роботи природа робочого тіла виявляє свої властивості. Формули, які використовувалися не підходять. Характеристики процесу знаходяться за І законом термодинаміки Q = ∆U + L або Q = ∆H + Lн. Тоді, якщо Q1-2=0, отримаємо
L1-2=-∆U1-2=-832.5 кДж
Lн1-2=-∆Н1-2=-1488 кДж
На основі останніх рівнянь складемо схему енергобалансу.

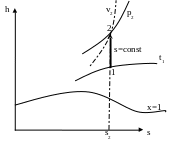
 Зобразимо
процес 1-2 у hs-, Ts-, i
pv- координатах.
Зобразимо
процес 1-2 у hs-, Ts-, i
pv- координатах.

Запишемо отриманні дані в таблицю 4.
Таблиця 4
Процеси |
∆Uі, кДж |
∆Hі, кДж |
∆Sі, кДж/K |
Qі, кДж |
Lі, кДж |
Lні, кДж |
1-2 |
832.5 |
1488 |
0 |
0 |
-832.5 |
-1488 |
2-3 |
386.1 |
126 |
4.014 |
2833.814 |
2447.784 |
2707.884 |
3-4 |
-522.6 |
-678 |
-0.789 |
-522.6 |
0 |
144.48 |
4-5 |
-684 |
-906 |
-1.755 |
-906 |
-218.67 |
0 |
5-1 |
-12 |
-30 |
-1.47 |
-658.56 |
-646.56 |
-628.56 |
∑ |
0 |
0 |
0 |
745.84 |
749.284 |
738.8 |
