
- •Иммуноэлектрофорез сыворотки крови
- •0,1% Раствор агарозы на воде
- •1% Агароза на 0,05 м трис-hCl буфере, рН 8,2
- •Двойная иммунодиффузия в геле Реактивы
- •Ход работы
- •0,3% Раствором h2o2 в метаноле (20 мин)
- •Результаты и обсуждение:
- •Иммуноэлектрофорез (ракетный форез) Реактивы
- •0,1% Раствор агарозы на воде
- •2% Агаpоза на барбитал-трис-глициновом буфере рН 8,8
- •1 М хлорид натрия
- •Ход работы
- •Для ферментативного выяления мпо
- •Для окраски на белок
- •Выделение из сыворотки фракции белков, обогащенной иммуноглобулинами, методом высаливания Реактивы
- •Ход работы
- •Иммуноаффинная хроматография Реактивы
- •Конъюгация антител с пероксидазой хрена периодатным методом Реактивы
- •Ход работы
- •Заливка гелей, электрофорез, электроперенос Ход работы Заливка гелей
- •Приготовление и нанесение проб.
- •Электрофорез
- •Электроперенос белковых фракций на нитроцеллюлозную мембрану
- •Окраска мембраны на белки
- •Иммунохимическая окраска мембраны после проведения электропереноса.
- •Количественное определение антигенов (миелопероксидазы или лактоферрина) методом твердофазного иммуноферментного анализа (elisa) («сандвич» вариант) Реактивы
- •Ход работы
- •Иммунохимическая окраска мембраны после проведения электропереноса и нанесения образцов на дот Реактивы
- •Ход работы
Для ферментативного выяления мпо
Заливали чашки Петри с гелями № 4,5,6 с сывороткой к МПО буфером для пероксидазной реакции так, чтобы гель был покрыт сверху и инкубировали 5 минут, далее буфер сливали.
Заливали реакционную смесь (готовили непосредственно перед реакцией).
Реакцию останавливали водой.
Для окраски на белок
Заливали стекла с остальными гелями 1 М NaCl и инкубировали в течение ночи, чтобы удалить следы неспецифического взаимодействия.
Промывали водой, для удаления соли.
Стекла помещали на желтый поднос на фильтровальную бумагу и в течение ночи гели высушивали на воздухе.
После стекла погружали вертикально с помощью пинцета в емкость с краской и крашивали в течение 15-30 секунд.
Отмывали стекла в растворе для отмывки до тех пор, пока четко не проявятся линии преципитации – «ракеты».
Затем стела высушивали на фильтровальной бумаге.
Результаты.
Построена калибровочная кривая для определения зависимости концентрации антител к МПО и к ЛФ от длины пробега «ракеты» (см. рис 1,2
Рис. 1 График зависимости концентрации антител к МПО от длины пробега «ракеты».

Рис. 2 График зависимости концентрации антител к ЛФ от длины пробега «ракеты».

По калибровочным кривым рассчитана концентрация антител к МПО и ЛФ в образцах: в слюне, в слезах, в экстракте белков лейкоцитов 1, человеческом молоке. Результаты приведены в таблице.
Образец |
Концентрация антител, мг/мл |
|
Антитела к МПО |
Антитела к ЛФ |
|
Слюна |
Не определяли |
0,26 |
Слезы |
Не определяли |
---* |
Молоко человека |
Не определяли |
---* |
Экстаракт белков лейкоцитов №1 |
0,72 |
1,51 |
---* значение концентрации не попадает в калибровочную кривую.

Рис. Ракетный иммуноэлектрофорез.
Выделение из сыворотки фракции белков, обогащенной иммуноглобулинами, методом высаливания Реактивы
4 М сульфат аммония
0,01 М натрий-фосфатный буфер, 0,15 М NaCl, рН 7,4
Ход работы
К сыворотке добавляли равный объем 4 М сульфата аммония: к 10 мл сыворотки к ЛФ 10 мл 4М сульфата аммония и к 10 мл сыворотки к МПО 10 мл 4 М сульфата аммония, и инкубировали 3 часа при температуре +4°С.
Затем пробы центрифугировали в течение 30 минут при 15000 g при +4°С.
Осадки растворяли в 5 мл дистиллированной воды и процедуру высаливания повторяли, добавляя 6 мл 4 М сульфата аммония и инкубировали 3 часа при температуре +4°С.
Затем пробы центрифугировали в течение 30 минут при 15000 g при +4°С.
Осадки растворяли в дистиллированной воде: в 5 мл для МПО и 4 мл для ЛФ, добавляли PBS в равном объеме, и подвергали диализу против 0,01 М натрий-фосфатного буфера, рН 7,4, содержащего 0,15 М NaCl, в течение ночи.
После диализа:
14 мл сыворотки к МПО (10 мл антител к МПО + 4 мл PBS промыли мембрану)
10 мл сыворотки к ЛФ (8 мл антител к ЛФ + 2 мл PBS промыли мембрану)
Иммуноаффинная хроматография Реактивы
1). Фосфатный буфер: 0,01 М натрий-фосфатный буфер, рН 7,4, содержащий 0,15 М NaCl. Приготовление 1 л фосфатного буфера: 100 мл 0,1 М натрий-фосфатного буфера, 150 мл 0,15 М NaCl, доводим до 1 л водой.
2). Раствор глицина: 0,1 М раствор глицина, рН 3,0 (доводят HCl), содержащий 0,15 М NaCl. Приготовление 1 л глицинового буфера: 7,5 г глицина, 8,8 г NaCl, добавляем 700 мл воды, доводим рН, добавляем воду до 1 л.
3). 0,05 М натрий-карбонатный буфер, рН 9,5
Ход работы
Приготовление колонки
В шприц опустили фильтр, нанесли 3-5 мл перемешанной бромциан-активированной агарозы с иммобилизованным антигеном (миелопероксидой или лактоферрином) в фосфатном буфере.
Предварительная подготовка колонки
Аффинные колонки с иммобилизованным антигеном (миелопероксидой или лактоферрином) промыли раствором глицина - 5 объемами (30 мл) каждую, затем колонки промыли фосфатным буфером (PBS) – 5 объемами каждую, оставили на ночь в холодильнике.
Аффинная хроматография
1) Колонки уравновесили фосфатным буфером – 5 объемами каждую.
2) Нанесли фракции сывороточных белков, обогащенные иммуноглобулинами. Эти фракции были получены диализом против 0,01 М натрий-фосфатного буфера, рН 7,4, содержащего 0,15 М NaCl; т. е.:
А) раствор АТ к ЛФ – 10 мл (в мембрану заливали 6 мл),
В) раствор АТ к МПО – 14 мл (в мембрану заливали 8 мл).
Элюаты с колонок собрали в пробирки «проскок», оставили при + 4º.
3) Колонки промыли фосфатным буфером до нулевых значений оптической плотности при длине волны 280 нм (на каждую колонку – 95 мл PBS).
4) Элюцию антител осуществляли раствором глицина-HCl (рН 3,0) со скоростью около 20 мл/ч (скорость элюции с колонки с иммобилизованным лактоферрином была меньше, чем с иммобилизованной миелопероксидзой; после перезабивания колонки с МПО скорость элюции с этой колонки стала меньше, чем с колонки с ЛФ). Для этого нанесли на колонку 1 колоночный объем (3 мл) глицинового буфера, собрали элюат в пробирки с №1, закрыли колонку и оставили на 15 минут для наилучшего последующего схождения АТ. Далее собрали элюаты еще в 23 пробирки для каждого раствора АТ.
5) Концентрацию антител определили по поглощению при длине волны 280 нм – 1 мг/мл дает значение оптической плотности 1,34.
6) Колонки промыли PBS (90 мл на каждую колонку).
После определения профиля элюции решено было повторить пункты 2-6 для колонки с пришитым ЛФ – 1 раз, а для колонки с пришитой МПО- 3 раза, при этом нанесение «проскока» в одном прогоне происходило дважды.
Полученные результаты представлены в таблицах и на графиках.
Таблица №1. АТ к МПО. Первый элюат.
№ пробирки |
Объем элюции, мл |
А 280 |
мг/мл |
мг в 3 мл |
1 |
3 |
0,09 |
0,067 |
0,201 |
2 |
6 |
0,28 |
0,209 |
0,627 |
3 |
9 |
0,11 |
0,082 |
0,246 |
4 |
12 |
0,055 |
0,041 |
0,123 |
5 |
15 |
0,04 |
0,030 |
0,090 |
6 |
18 |
0,03 |
0,022 |
0,067 |
7 |
21 |
0,026 |
0,019 |
0,058 |
8 |
24 |
0,022 |
0,016 |
0,049 |
9 |
27 |
0,02 |
0,015 |
0,045 |
10 |
30 |
0,02 |
0,015 |
0,045 |
11 |
33 |
0,025 |
0,019 |
0,056 |
12 |
36 |
0,03 |
0,022 |
0,067 |
13 |
39 |
0,025 |
0,019 |
0,056 |
14 |
42 |
0,025 |
0,019 |
0,056 |
15 |
45 |
0,02 |
0,015 |
0,045 |
16 |
48 |
0,02 |
0,015 |
0,045 |
17 |
51 |
0,02 |
0,015 |
0,045 |
18 |
54 |
0,025 |
0,019 |
0,056 |
19 |
57 |
0,015 |
0,011 |
0,034 |
20 |
60 |
0,02 |
0,015 |
0,045 |
21 |
63 |
0,035 |
0,026 |
0,078 |
22 |
66 |
0,02 |
0,015 |
0,045 |
23 |
69 |
0,02 |
0,015 |
0,045 |
24 |
72 |
0,015 |
0,011 |
0,034 |
Таблица №2. АТ к МПО. Второй элюат.
№ пробирки |
Объем элюции, мл |
А 280 |
мг/мл |
мг в 3 мл |
1' |
3 |
0,4 |
0,299 |
0,896 |
2’ |
6 |
0,15 |
0,112 |
0,336 |
3’ |
9 |
0,06 |
0,045 |
0,134 |
4’ |
12 |
0,045 |
0,034 |
0,101 |
5’ |
15 |
0,04 |
0,030 |
0,090 |
6’ |
18 |
0,025 |
0,019 |
0,056 |
Таблица №3. АТ к МПО. Третий элюат.
№ пробирки |
Объем элюции, мл |
А 280 |
мг/мл |
мг в 3 мл |
1’’ |
3 |
0,155 |
0,116 |
0,347 |
2’’ |
6 |
0,3 |
0,224 |
0,672 |
3’’ |
9 |
0,109 |
0,081 |
0,244 |
4’’ |
12 |
0,065 |
0,049 |
0,146 |
5’’ |
15 |
0,045 |
0,034 |
0,101 |
6’’ |
18 |
0,035 |
0,026 |
0,078 |
7’’ |
21 |
0,03 |
0,022 |
0,067 |
8’’ |
24 |
0,021 |
0,016 |
0,047 |
9’’ |
27 |
0,019 |
0,014 |
0,043 |
10’’ |
30 |
0,015 |
0,011 |
0,034 |
Таблица №4. АТ к МПО. Четвертый элюат.
№ пробирки |
Объем элюции, мл |
А 280 |
мг/мл |
мг в 3 мл |
1’’’ |
3 |
0,165 |
0,123 |
0,369 |
2’’’ |
6 |
0,193 |
0,144 |
0,432 |
3’’’ |
9 |
0,06 |
0,045 |
0,134 |
4’’’ |
12 |
0,036 |
0,027 |
0,081 |
1’’’ |
3 |
0,165 |
0,123 |
0,369 |
2’’’ |
6 |
0,193 |
0,144 |
0,432 |


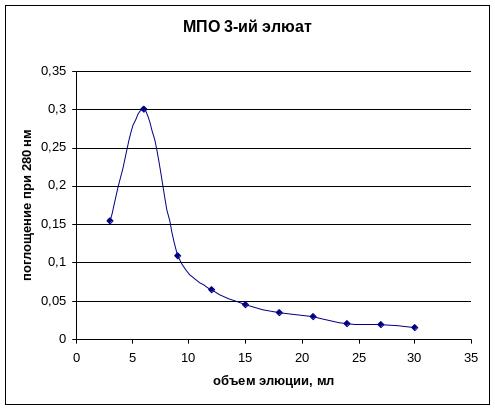

Таблица №5. АТ к ЛФ. Первый элюат.
№ пробирки |
Объем элюции, мл |
А 280 |
мг/мл |
мг в 3 мл |
1 |
3 |
0,26 |
0,194 |
0,582 |
2 |
6 |
1,7 |
1,269 |
3,806 |
3 |
9 |
0,7 |
0,522 |
1,567 |
4 |
12 |
0,33 |
0,246 |
0,739 |
5 |
15 |
0,218 |
0,163 |
0,488 |
6 |
18 |
0,168 |
0,125 |
0,376 |
7 |
21 |
0,118 |
0,088 |
0,264 |
8 |
24 |
0,1 |
0,075 |
0,224 |
9 |
27 |
0,09 |
0,067 |
0,201 |
10 |
30 |
0,065 |
0,049 |
0,146 |
11 |
33 |
0,065 |
0,049 |
0,146 |
12 |
36 |
0,059 |
0,044 |
0,132 |
13 |
39 |
0,055 |
0,041 |
0,123 |
14 |
42 |
0,051 |
0,038 |
0,114 |
15 |
45 |
0,0505 |
0,038 |
0,113 |
16 |
48 |
0,048 |
0,036 |
0,107 |
17 |
51 |
0,046 |
0,034 |
0,103 |
18 |
54 |
0,042 |
0,031 |
0,094 |
19 |
57 |
0,039 |
0,029 |
0,087 |
20 |
60 |
0,031 |
0,023 |
0,069 |
21 |
63 |
0,029 |
0,022 |
0,065 |
22 |
66 |
0,027 |
0,020 |
0,060 |
23 |
69 |
0,025 |
0,019 |
0,056 |
24 |
72 |
0,02 |
0,015 |
0,045 |
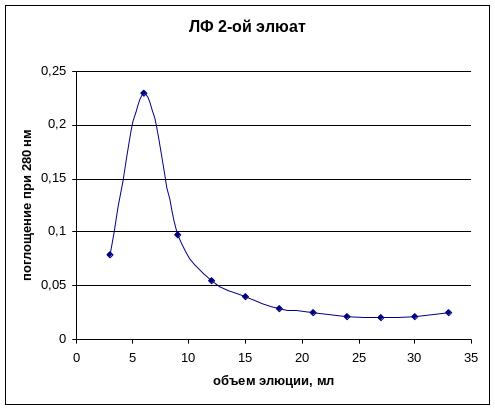
Таблица №6. АТ к ЛФ. Второй элюат.
№ пробирки |
Объем элюции, мл |
А 280 |
мг/мл |
мг в 3,5 мл |
1’ |
3 |
0,079 |
0,059 |
0,206 |
2’ |
6 |
0,23 |
0,172 |
0,601 |
3’ |
9 |
0,098 |
0,073 |
0,256 |
4’ |
12 |
0,055 |
0,041 |
0,144 |
5’ |
15 |
0,04 |
0,030 |
0,104 |
6’ |
18 |
0,029 |
0,022 |
0,076 |
7’ |
21 |
0,025 |
0,019 |
0,065 |
8’ |
24 |
0,021 |
0,016 |
0,055 |
9’ |
27 |
0,02 |
0,015 |
0,052 |
10’ |
30 |
0,021 |
0,016 |
0,055 |
11’ |
33 |
0,025 |
0,019 |
0,065 |

Исходя из полученных результатов, для конъюгации полученных из сыворотки крови первых АТ с пероксидазой хрена (ПХ) было объединено содержимое следующих пробирок и подвергнуто диализу в течение ночи при +4°С против 0,05 М натрий-карбонатного буфера, рН 9,5:
АТ к ЛФ – 1 и 3 (т.е. 2,1 мг на 6 мл);
АТ к МПО -1, 2 и 1' (т.е. 1,7 мг на 9 мл).
Концентрацию АТ к МПО и ЛФ в объединенных элюатах до и после диализа определили по поглощению при длине волны 280 нм – 1 мг/мл дает значение оптической плотности 1,34. Результаты представлены в таблице №7.
Таблица №7.Содержание АТ к ЛФ и МПО до и после диализа против натрий-карбонатного буфера перед конъюгацией.
Типы АТ |
А 280 до диализа |
объем до диализа, мл |
содержание АТ до диализа, мг |
А 280 после диализа |
конечный объем после диализа |
конечное содержание АТ после диализа, мг |
АТ к МПО |
0,26 |
9 |
1,7 |
0,305 |
10 |
2,35 |
АТ к ЛФ |
0,49 |
6 |
2,1 |
0,42 |
7,5 |
2,28 |
ВЫВОД: Поскольку на 1 мг АТ требуется для конъюгации 1,5 г пероксидазы хрена, то на 2,1 мг АТ к ЛФ и на 1,7 мг АТ к МПО требуется (1,7+2,1)*1,5=5,7 мг ПХ. Поскольку конечное содержание АТ к ЛФ и к МПО после диализа приблизительно одинаково (2,28 и 2,35 соответственно), то активированную пероксидазу, предварительно подвергнутую диализу против натрий-ацетатного буфера, добавляют в равных объемах к антителам (после диализа объем активированной пероксидазы составил 3 мл, т.е. к АТ к ЛФ и к МПО добавили по 1,5 мл активированной пероксидазы хрена).
Для перевода АТ в PBS было объединено содержимое следующих пробирок и подвергнуто диализу против 0,01 М натрий-фосфатного буфера, рН 7,4, содержащего 0,15 М NaCl в течение ночи при +4°С:
АТ к ЛФ – 2, 4, 5, 6, 7, 8, 9, 1', 2' и 3' (т.е. 7,2 мг на 33 мл);
АТ к МПО -3 и 2'; 4', 1'', 2'' и 3''; 4'', 1''', 2''' и 3'''; (т.е. 0,6 мг на 6 мл;1,4 мг на 12 мл; 1,1 мг на 12 мл).
Концентрацию АТ к МПО и ЛФ в объединенных элюатах до и после диализа определили по поглощению при длине волны 280 нм – 1 мг/мл дает значение оптической плотности 1,34. Результаты представлены в таблице №8.
Таблица №8.Содержание АТ к ЛФ и МПО до и после диализа против натрий-фосфатного буфера.
Типы АТ |
А 280 до диализа |
объем до диализа, мл |
содержание АТ до диализа, мг |
А 280 после диализа |
конечный объем после диализа |
конечное содержание АТ после диализа, мг |
АТ к МПО |
0,15 |
6 |
0,6 |
0,.15 |
6 |
0,.7 |
АТ к ЛФ |
----- |
30 |
7,2 |
0,.36 |
30 |
8,1 |
