
- •Иммуноэлектрофорез сыворотки крови
- •0,1% Раствор агарозы на воде
- •1% Агароза на 0,05 м трис-hCl буфере, рН 8,2
- •Двойная иммунодиффузия в геле Реактивы
- •Ход работы
- •0,3% Раствором h2o2 в метаноле (20 мин)
- •Результаты и обсуждение:
- •Иммуноэлектрофорез (ракетный форез) Реактивы
- •0,1% Раствор агарозы на воде
- •2% Агаpоза на барбитал-трис-глициновом буфере рН 8,8
- •1 М хлорид натрия
- •Ход работы
- •Для ферментативного выяления мпо
- •Для окраски на белок
- •Выделение из сыворотки фракции белков, обогащенной иммуноглобулинами, методом высаливания Реактивы
- •Ход работы
- •Иммуноаффинная хроматография Реактивы
- •Конъюгация антител с пероксидазой хрена периодатным методом Реактивы
- •Ход работы
- •Заливка гелей, электрофорез, электроперенос Ход работы Заливка гелей
- •Приготовление и нанесение проб.
- •Электрофорез
- •Электроперенос белковых фракций на нитроцеллюлозную мембрану
- •Окраска мембраны на белки
- •Иммунохимическая окраска мембраны после проведения электропереноса.
- •Количественное определение антигенов (миелопероксидазы или лактоферрина) методом твердофазного иммуноферментного анализа (elisa) («сандвич» вариант) Реактивы
- •Ход работы
- •Иммунохимическая окраска мембраны после проведения электропереноса и нанесения образцов на дот Реактивы
- •Ход работы
Санкт-Петербургский государственный университет
Биолого-почвенный факультет
Кафедра биохимии
Отчет по практикуму по иммунохимии
(02.12.2008 — 11.12.2008)
Подготовили студенты II курса магистратуры
А. Барабанова,
И. В. Войнова,
К. Н. Данилова,
К. Е. Карпачева,
А. Б. Комиссаров,
В. Б. Филимонов,
О. В. Черкалина
Санкт-Петербург
2008
Иммуноэлектрофорез сыворотки крови
Реактивы
0,1% Раствор агарозы на воде
1% Агароза на 0,05 м трис-hCl буфере, рН 8,2
Электродный буфер: 0,05 М трис-HCl буфер, рН 8,2
Буфер для разведения сывороток: 0,01 М натрий фосфатный, pH 7,4
Раствор бромфенолового синего
Блокирующий буфер: 10 мМ трис-HCl, 100 М NaCl, pH 7,4, содержащий 3% сухого обезжиренного молока.
Буфер для промывки: 10 мМ трис-HCl, 100 мМ NaCl, pH 7,4, содержащий 0,1% твин20.
Буфер для разведения антигенов и коньюгатов: 10 мМ трис-HCl, 100 М NaCl, pH 7,4, содержащий 0,3% сухого обезжиренного молока.
Раствор Понсо: 2% Понсо S, 30% трихлоруксусная кислота, 30% сульфосалициловая кислота.
Раствор субстрата (готовится непосредственно перед использованием): 0,067% 3-амино-9-этил-карбазол (АЭК), 17% этанол, 0,025% перекись водорода на воде.
Ход работы
Чистые, сухие стекла погрузили в 0,1% раствор агарозы на воде и аккуратно высушили в вертикальном положении. Разместили стекла на установленном горизонтально столике для заливки. 1%-ную агарозу расплавили. Гоpячий раствор 1% агарозы заливали по 3 мл на стекло. Толщина геля пpи этом - 1-2 мм.
В середине застывшего геля с помощью усеченного наконечника формировали 2 лунки. В одну лунку вносили цельную сыворотку, в другую – эту же сыворотку, но разведенную в 2 раза 0,01 М натрий-фосфатным буфером, рН 7,4 (см. табл. 1). Всего приготовили 12 гелей (гели 1–6 и 1’–6’ содержали одинаковые пробы, но были предназначены для электрофореза различной продолжительности).
Табл. 1. Иммуноэлектрофорез сыворотки крови. Нанесение проб
Гель-стекло |
Лунка 1 |
Лунка 2 |
Окрашивание после переноса на мембрану |
1, 1’ |
сыворотка №1 к лактоферрину |
те же сыворотки, разведенные в 2 раза |
окраска Понсо S |
2, 2’ |
сыворотка №1 к лактоферрину |
иммуноокрашивание |
|
3, 3’ |
сыворотка №3 к лактоферрину |
иммуноокрашивание |
|
4, 4’ |
сыворотка №2 к миелопероксидазе |
окраска Понсо S |
|
5, 5’ |
сыворотка №2 к миелопероксидазе |
иммуноокрашивание |
|
6, 6’ |
сыворотка №4 к миелопероксидазе |
иммуноокрашивание |
Объем вносимых проб - 20 мкл (реально в лунки попадало 12-15 мкл). К пробам добавили произвольное количество лидирующего красителя бромфенолового синего.
Стекла поместили на подложку, а затем в камеру для иммуноэлектрофореза.
Электрофорез проводили пpи силе тока 20 мА (100 V); начинали форез при силе тока 10 мА. За ходом электрофореза следили по положению красителя бромфенолового синего.
Электрофорез в первой камере остановили, когда бромфеноловый синий достиг середины между краем стекла и лунки, во второй камере – когда бромфеноловый синий был у края стекла. (Приблизительное время электрофореза 1,5 и 2,5 часа соответственно).
После проведения электрофореза стекла с гелями расположили горизонтально, у всех гелей отрезали верхний правый уголок; на гели сверху положили нитроцеллюлозные мембраны, далее слой фильтровальной бумаги толщиной 1-2 см, сверху поставили груз: около 5 кг. Перенос проводили в течение 35 минут.
Мембраны с номерами 1, 4, 1’, 4’ – окрашивали красителем Понсо, выявляя тотальные белки. Остальные мембраны окрашивали иммунохимически (выявляли антитела к данным антигенам).
Окраска мембран на белки
Мембраны помещали в чашки Петри и окрашивали на белок раствором Понсо S в течение 5 минут на качалке при комнатной температуре. Отмывали мембрану дистиллированной водой. (см. рис. 1)
Иммунохимическая окраска мембран
Нитроцеллюлозную мембрану инкубировали в блокирующем буфере в течение 30 минут при +37°С, при перемешивании (в термостате, на качалке).
Происходит блокирование свободных участков мембраны, не занятых белками после переноса. Это препятствует неспецифическому связыванию антител с мембраной.
Дважды ополаскивали буфером для промывки. Затем инкубировали мембрану в растворе антигена (1 мкг/мл) в течение 60 минут при +37°С в термостате на качалке. Тщательно отмывали от несвязавшегося антигена буфером для промывки 3 раза по 5 минут на качалке при комнатной температуре.
Мембрану инкубировали в растворе первичных антител, конъюгированных с пероксидазой хрена, разведенных в 300 раз, в течение 60 минут при +37°С, при перемешивании (в термостате на качалке). Тщательно отмывали от несвязавшегося коньюгата буфером для промывки 3 раза по 5 минут на качалке при комнатной температуре.
Мембрану споласкивали водой и инкубировали в растворе субстрата, не допуская прямого попадания яркого света, наблюдая за развитием окраски. Реакцию останавливливали промыванием мембраны дистиллированной водой и высушивали на воздухе.

Рис. 1. Мембраны, окрашенные красителем Понсо (мембраны 1, 4, 1’, 4’)

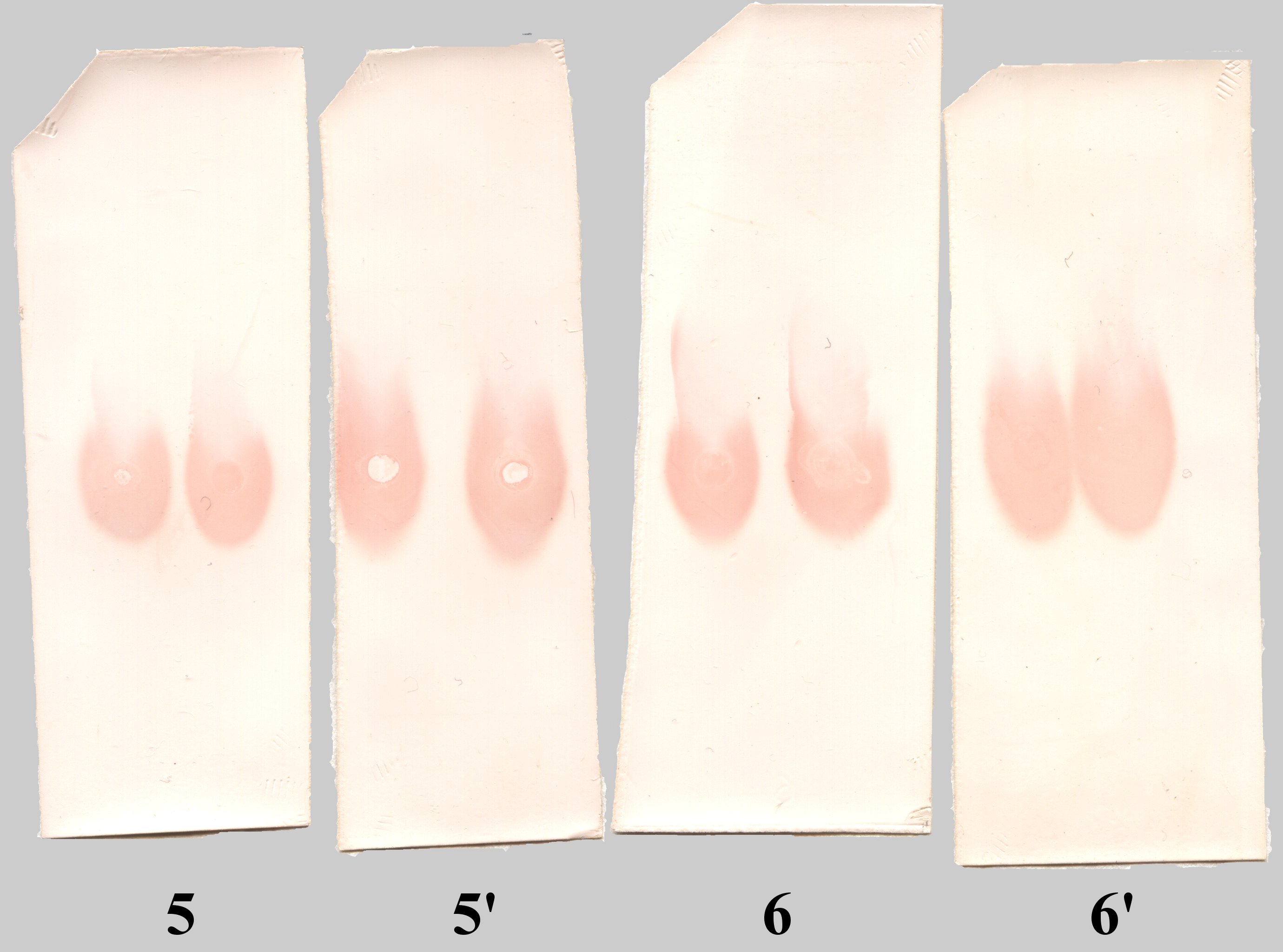
Рис. 2. Мембраны 2, 2’, 3, 3’, 5, 5’, 6, 6’
Результаты и обсуждение
В сыворотке были выявлены антитела к лактоферрину и миелопероксидазе человека. Иммуноглобулины (IgG) малоподвижны, иммунохимически выявляются в зоне старта. Медленно двигались к катоду (см. рис 2). Возможно, низкая электрофоретическая подвижность иммуноглобулинов объясняется малой разницей между значениями их pI и pH электродного буфера Тотальный белок выявляли окрашиванием Понсо S (см. рис. 1) Альбумины в данной электрофоретической системе обладали высокой подвижностью и перемещались к аноду.
