
- •Химическая кинетика
- •Методы определения порядка рекации
- •Влияние температуры на скорость химических реакций
- •Катализ
- •Гомогенный катализ
- •Определение константы скорости реакции гидролиза сложного эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости инверсии тростникового сахара
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции омыления уксусноэтилового эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции второго порядка
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Определение энергии активации гомогенной реакции
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
- •Экспериментальная часть
- •Работа 6 а
- •Работа 6 б изучение вторичного солевого эффекта
- •Контрольные вопросы
- •Исследование скорости окисления металлов при высоких температурах Теоретическое введение
- •Экспериментальная часть
- •Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
- •Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
- •Изучение скорости мутаротации глюкозы Теоретическая часть
- •Последовательность выполнения работы
- •Литература
Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
Иодирование ацетона катализируется в водных растворах протонами
![]() (32)
(32)
и протекает в две стадии:
энолизация ацетона (с образованием промежуточного вещества)
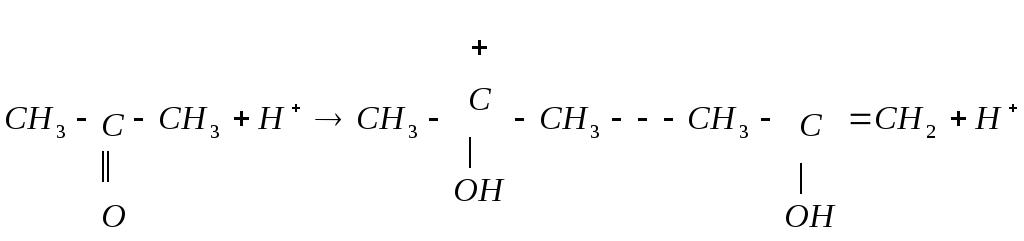 ; (33)
; (33)
взаимодействие йода с энольной формой
![]() . (34)
. (34)
| ||
OH O
Первая реакция протекает значительно медленнее второй, поэтому скорость процесса определяется скоростью первой стадии, которая пропорциональна концентрации ацетона и ионов водорода, но не зависит от концентрации йода. Реакция проходит автокаталитически, так как ускоряется одним из продуктов реакции (Н+). В нейтральном разбавленном водном растворе она протекает очень медленно.
Скорость расходования ацетона выражается кинетическим уравнением второго порядка в соответствии с уравнением лимитирующей стадии:
![]() =k (C0
– Cх)(C0,H+
+ Cx),(35)
=k (C0
– Cх)(C0,H+
+ Cx),(35)
где C0–концентрация ацетона начальная;C0,H+- начальная концентрация ионов водорода;Cх– концентрация ацетона, подвергающаяся превращению за время(убыль концентрации);- время от начала реакции до данного измерения.
Интегрирование выражения (4) дает уравнение константы скорости процесса:
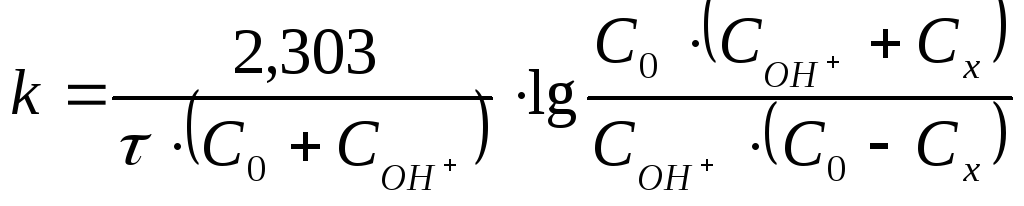 . (36)
. (36)
Для графической проверки это уравнение используют в линейной форме:
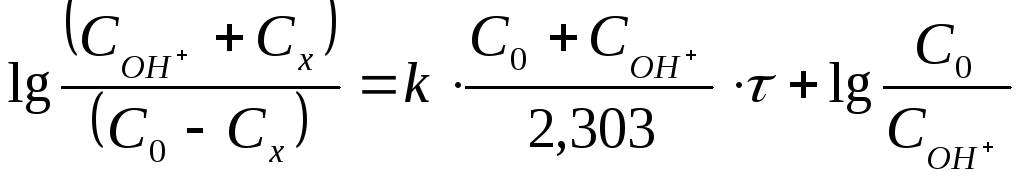 . (37)
. (37)
Экспериментальная часть
В работе исследуется зависимость константы скорости реакции от начальной концентрации катализатора (по указанию преподавателя), а также изучается первичный и вторичный солевой эффект.
В каждую из четырех 200 мл мерных колб вливают 25 мл 0,1 Nраствора йода в 4 %-ном растворе КI, прибавляют к нему 25 мл соляной кислоты концентрации от 0,3 до 1,5N(по указанию преподавателя) и разбавляют дистиллированной водой до объема 150 мл.
Ацетон – около 1,5 г – берут пипеткой (1,6-2,0 мл) и сливают в колбочку, содержащую 10 мл воды. Приготовленный раствор ацетона приливают в колбу с раствором йода и кислоты, после чего смесь доводят до метки дистиллированной водой. Момент вливания ацетона принимают за начало реакции. Аналогичную процедуру проделывают с остальными растворами йода с интервалом в 2-3 мин.
Первую пробу объемом 10 мл берут сразу же после доведения смеси до метки взбалтывания. Последующие пробы того же объема целесообразно брать через каждые 15-20 мин (всего 8-10 проб). Чем меньше концентрация кислоты, тем реже следует брать пробы.
Анализ пробы ведут следующим образом: пробу 10 мл вливают в 10 мл 0,1 NраствораNaHCO3и титруют по йоду 0,01 N растворомNa2S2O3с крахмалом в качестве индикатора. По ходу реакции время между последовательными титрованиями нужно постепенно увеличивать.
Концентрацию ацетона определяют по уравнению
![]() ,
(38)
,
(38)
где n- количество 0,01NNa2S2O3, израсходованного на титрование пробы, мл;n0– количествоNa2S2O3, которое должно быть израсходовано на титрование в момент начала реакции, мл;N– нормальность раствораNa2S2O3.
Значение n0практически
определить не удается, поскольку от
момента вливания ацетона до момента
взятия первой пробы проходит некоторое
время. Поэтому для определенияn0строят график в координатахn=f(![]() )
и экстраполяцией до
)
и экстраполяцией до![]() = 0 находят искомую величину.
= 0 находят искомую величину.
1. Расчет константы скорости проводят для каждой пробы и находят среднее значение.
2. Используя линейную форму уравнения
(37), строят графики в координатах
![]() .
Из наклона каждой прямой находят значения
констант скорости и сравнивают с
рассчитаннымиkср.
.
Из наклона каждой прямой находят значения
констант скорости и сравнивают с
рассчитаннымиkср.
3. Строят график зависимости константы скорости от концентрации кислоты.
4. Данные эксперимента и расчеты помещают в табл. 5.
Таблица 5
|
Объем титруемой пробы – 10 мл, … г-экв/л, объем прибавленной кислоты – 25 мл, … г-экв/л, Нормальность кислоты - … N | |||||||
|
№ |
|
n |
Cx |
|
k |
kср |
lg kcp |
