
- •Химическая кинетика
- •Методы определения порядка рекации
- •Влияние температуры на скорость химических реакций
- •Катализ
- •Гомогенный катализ
- •Определение константы скорости реакции гидролиза сложного эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости инверсии тростникового сахара
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции омыления уксусноэтилового эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции второго порядка
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Определение энергии активации гомогенной реакции
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
- •Экспериментальная часть
- •Работа 6 а
- •Работа 6 б изучение вторичного солевого эффекта
- •Контрольные вопросы
- •Исследование скорости окисления металлов при высоких температурах Теоретическое введение
- •Экспериментальная часть
- •Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
- •Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
- •Изучение скорости мутаротации глюкозы Теоретическая часть
- •Последовательность выполнения работы
- •Литература
Экспериментальная часть
И сследование
кинетики газовой коррозии проводится
по методике периодического взвешивания
на лабораторной установке, схема которой
приведена на рис. 4.
сследование
кинетики газовой коррозии проводится
по методике периодического взвешивания
на лабораторной установке, схема которой
приведена на рис. 4.
Испытуемый образец 2 подвешивают на нихромовом или кварцевом подвесе 5, состоящем из нескольких звеньев, в вертикальной трубчатой печи сопротивления 3, к коромыслу аналитических весов 6. Температуру в печи замеряют хромель-алюмелевой термопарой 1 и записывают на потенциометре КСП – 4 – 7. Конец термопары должен находиться вблизи испытуемого образца. Чтобы избежать нагрева весов, между печью и весами устанавливается экран 4.
Работа по исследованию скорости окисления металла проводится следующим образом: включают обогрев печи и потенциометр КСП – 4. По достижению заданной температуры (регулируют при помощи ЛАТРа) подвешивают в печи испытуемый образец 2 и через 1 – 2 мин его взвешивают. За это время образец принимает температуру печи, но еще не успевает заметно окислиться. Далее в течение 1 – 2 ч через заданные преподавателем промежутки времени продолжают взвешивание образца. По окончании опыта при данной температуре образец вынимают, устанавливают в печи следующую заданную температуру, подвешивают в печи новый образец такого же металла и повторяют опыт в том же порядке.
Результаты опытов по исследованию кинетики газовой коррозии сводят в таблицу по образцу. По табличным данным для каждой температуры строят графики в координатах G1–τ,ΔG12–τиΔG1–lnτ, устанавливая таким образом, по какому закону идет окисление в определенной температурной области.
|
Темпе-ратура, К |
Металл и номер образца |
Поверхность образца, м2 |
Вермя и но-мер вз-вешивания |
Время от начала опыта, τ |
Масса образца, G1, кг |
Привес ΔG1, кг |
Привес на единицу поверхности ΔG1, кг |
Установив характер кривой и какому уравнению она подчиняется, рассчитывают константу скорости окисления при любой температуре, а затем определяют энергию активации и получают расчетное уравнение процесса окисления в зависимости от температуры. Для определения константы скорости окисления расчет проводится по формулам:
- при прямолинейном характере кривых
окисления
![]() ;
;
- при параболическом характере кривых
![]() ;
;
при логарифмическом законе окисления
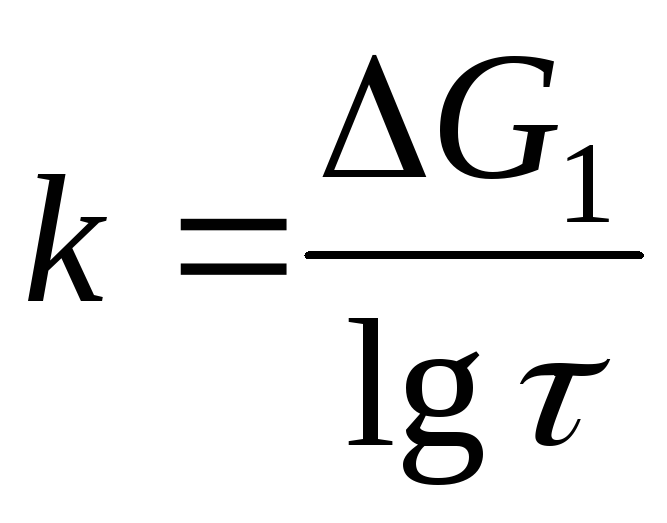 .
.
Контрольные вопросы
1. Почему нет единого уравнения для газовой коррозии металлов?
2. Каковы признаки диффузионного торможения гетерогенного процесса?
3. Напишите уравнения Фика для 1 и 2 закона диффузии.
4. Расскажите о механизмах окисления различных металлов.
Лабораторная работа 8
Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
Всякий гетерогенный процесс включает в себя несколько стадий. Как правило, основные из них - транспорт реагирующих веществ к реакционной поверхности, собственно химическая реакция, отвод продуктов реакции в объем. В зависимости от условий проведения процесса и его особенностей наиболее медленной может быть любая из трех стадий. Если лимитирующими являются первая и третья стадии, то скорость процесса зависит от скорости переноса вещества посредством диффузии. Такой процесс называют диффузионным.
Большое значение имеют диффузионные влияния в процессах испарения жидкостей и сублимации твердых тел. Они играют ведущую роль при сушке, перегонке и т.д. – везде, где скорость процесса лимитируется отводом пара от поверхности конденсированной фазы. Процесс диффузии подчиняется первому закону Фика
Y= -D(dC/dx), (49)
где Y= 1/Sdm/d- количествоmвещества, проходящее за времяdчерез сечениеS(диффузионный поток, г/см2с);D– коэффициент диффузии;dC/dx– градиент концентрации.
Знак «-» показывает, что диффузия идет в направлении убывания концентрации. Величина Dпредставляет собой удельную скорость диффузии, т.е. количество вещества, проходящего в единицу времени через единицу поверхности при единичном градиенте концентрации. Как следует из выражения (1), коэффициентDимеет размерностьD= (длина)2/время, а выражают его обычно в см2/с.
Кинетическая сторона диффузии ясна из следующих рассуждений. Если на границе раздела фаз концентрация испаряющегося вещества равна Сs, а на расстоянии- С и равна концентрации в глубине объемаV, то можно приближенно заменить
- dC/dx = (Cs- C)/ (50)
и I = D(Cs – C)/. (51)
Разделив обе части уравнения (3) на объем и переходя к концентрации, получим
![]() .
(52)
.
(52)
Отсюда скорость диффузии запишется
![]() . (53)
. (53)
Таким образом, скорость диффузии кинетически подчиняется уравнению первого порядка относительно концентрации в объеме. Интегрирование (53) дает обычное выражение для константы массопереноса =DS/V, которая является аналогом константы скорости
![]() , (54)
, (54)
где С0– начальная концентрация диффундирующего вещества в объеме.
Диффузия – процесс относительно медленный. Это объясняется тем, что каждая молекула диффундирующего вещества испытывает огромное число соударений и перемещается по сложной траектории, длина которой несоизмеримо велика по сравнению с расстоянием, проходимым молекулой в направлении диффузии.
Вследствие этого лишь небольшая часть молекул, вырвавшихся из жидкости, успевает удалиться от ее поверхности на значительное расстояние. В тонком слое газа над самой поверхностью накапливаются молекулы испаряющегося вещества, и парциальное давление паров растет до тех пор, пока не станет почти равным давлению насыщенного пара. В общем случае говорят: если процесс лимитируется диффузией, то около поверхности раздела фаз устанавливается состояние, близкое к равновесному.
Для экспериментального определения коэффициентов диффузии чаще всего создают такие условия, в которых процесс испарения и диффузии паров протекает стационарно. В стационарном процессе скорость его, а также концентрация вещества в любой точке системы не меняются со временем. Такой процесс диффузии легко рассчитать.
Например, для описания скорости стационарного испарения жидкости в вертикальной цилиндрической трубе, у верхнего среза которой поддерживается постоянное парциальное давление паров Р0, Стефан получил уравнение
![]() , (55)
, (55)
которое позволяет выразить коэффициент диффузии через измеряемые в опыте величины
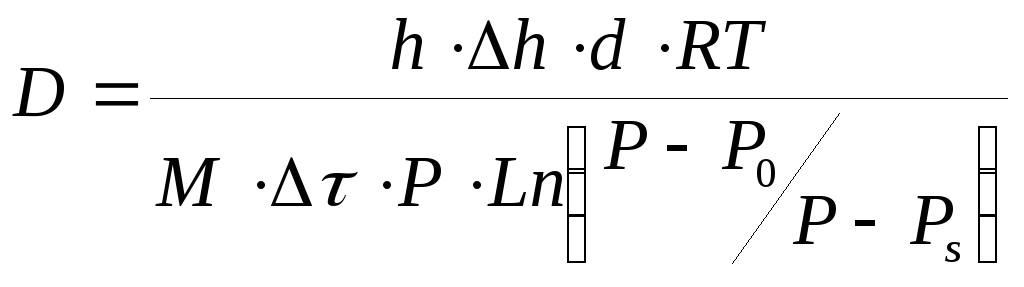 , (56)
, (56)
где С = МР/РТ – концентрация диффундирующего вещества (г/см3), соответствующая его парциальному давлению, которое равно общему атмосферному давлению Р; М – молекулярный вес жидкости; Рs– давление насыщенных паров жидкости при температуре Т;d– плотность жидкости;h- расстояние от поверхности жидкости до верхнего среза трубы;h– измерение высоты уровня жидкости в результате испарения за время;R– универсальная газовая постоянная.
С повышением температуры коэффициент диффузии возрастает экспоненциально в жидкостях и твердых телах
D = D0exp(-E/RT)(57)
и по степенной зависимости в газах
D2/D1 = (T2/T1)n.(58)
Значение показателя степени в последнем уравнении лежит обычно в пределах 1,6-2,0.
Анализ нестационарного процесса испарения жидкости из вертикальной цилиндрической трубы показывает, что данный процесс должен подчиняться уравнению
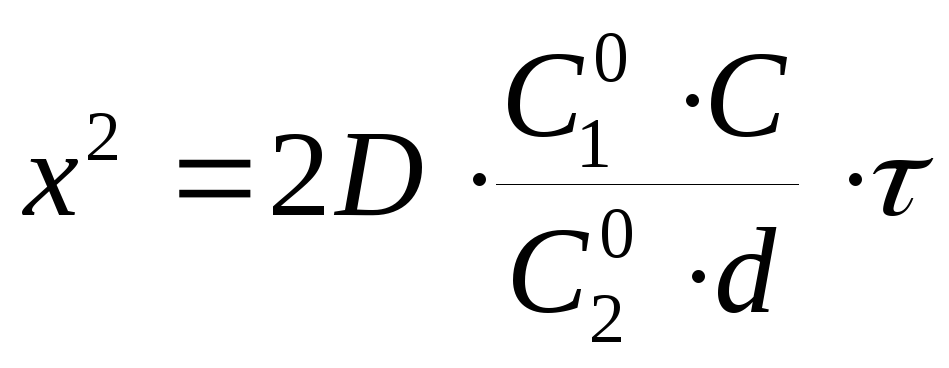 ,
(59)
,
(59)
где х – расстояние, на которое переместилась в трубке граница жидкость-пар за время ; С20– концентрация воздуха на межфазной границе (кг/м3); С10– концентрация насыщенного пара жидкости на границе (кг/м3); С = С10+ С20.
Экспериментальная часть
В держатели штатива зажимают две тонкие (4-6 мм диаметром) стеклянные пробирки. Одна из них служит для определения коэффициентов диффузии пара жидкости при стационарном процессе испарения по уравнению Стефана (8) (метод 1), другая – для расчета скорости нестационарного испарения по уравнению (11) (метод 2).
Метод 1. Исследуемую жидкость наливают в пробирку на 50-80 мм ниже ее верхнего среза. Через 30 мин, в течение которых происходит установление стационарного состояния, начинают измерения при помощи катетометра. Измерятьhнужно с большой точностью, так как испарение идет медленно иhвыражается десятыми долями миллиметра. Отсчеты снимают через 20-40 мин. За время опыта снимают 6-7 отсчетов и строят графикh,, позволяющий судить о стационарности процесса испарения (dh/d=const). По уравнению (8) рассчитывают коэффициент диффузии пара жидкости в воздухе. За высотуhпринимают среднее ее значение за время опыта (высота диффузионного пространства).
Измерения заносят в таблицу и представляют в виде графиков:
h = f();
h / = f().
Метод 2.Пробирку заполняют исследуемой жидкостью полностью до верхнего среза. Измерения перемещения межфазной границы во времени производят микрометром, постепенно увеличивая время между измерениями от 15-20 до 40-45 мин. Всего снимают 6-7 отсчетов.
Измерения заносят в таблицу и представляют в виде графиков:
х = f();
х2= f();
зависимость скорости испарения I=idоти-1.
i– скорость перемещения межфазной границы,i=dx/d. По тангенсу угла наклона графика с учетом давления насыщенного пара исследуемой жидкости при температуре опыта рассчитываютDи сравнивают с полученным значением по методу 1 и литературным данным.
Расчет поверхностных концентраций для метода 2 описан в работе 5.
Контрольные вопросы
Как зависит скорость испарения жидкости от температуры?
Каковы признаки диффузионного торможения гетерогенного химического процесса?
Каков порядок реакции, которая лимитируется диффузией?
4. Назовите примеры химико-технологических процессов, где важно знать закономерности массопереноса.
Лабораторная работа 9
