
- •Химическая кинетика
- •Методы определения порядка рекации
- •Влияние температуры на скорость химических реакций
- •Катализ
- •Гомогенный катализ
- •Определение константы скорости реакции гидролиза сложного эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости инверсии тростникового сахара
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции омыления уксусноэтилового эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции второго порядка
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Определение энергии активации гомогенной реакции
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
- •Экспериментальная часть
- •Работа 6 а
- •Работа 6 б изучение вторичного солевого эффекта
- •Контрольные вопросы
- •Исследование скорости окисления металлов при высоких температурах Теоретическое введение
- •Экспериментальная часть
- •Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
- •Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
- •Изучение скорости мутаротации глюкозы Теоретическая часть
- •Последовательность выполнения работы
- •Литература
Отчет по работе
должен содержать:
-теоретическое обоснование экспериментальной части работы и методику эксперимента,
-экспериментально измеренные объемы титрования,
-графики зависимости : объем титранта- время, константа скорости реакция - обратная температура,
-расчёт константы скорости и её среднего значения,
- мотивированное обоснование ошибки измерения всех величин.
Лабораторная работа 2
Определение константы скорости инверсии тростникового сахара
ЦЕЛЬ РАБОТЫ:определение константы скорости инверсии сахарозы, освоение графического метода определения константы скорости реакции первого порядка.
ПРИБОРЫ И РЕАКТИВЫ: тростниковый сахар или сахароза, 1.0нсоляная кислота, мерные пипетки на 25мл, технохимические весы, поляриметр, поляриметрическая трубка, фильтровальная бумага.
Методика эксперимента
Тростниковый сахар
![]() в водном растворе испытывает превращение,
называемое инверсией сахара. Взаимодействуя
с водой, он распадается на глюкозу и
фруктозу по уравнению:
в водном растворе испытывает превращение,
называемое инверсией сахара. Взаимодействуя
с водой, он распадается на глюкозу и
фруктозу по уравнению:
![]() .
(27)
.
(27)
При наличии избытка воды эта реакция
протекает как реакция первого порядка,
поэтому константа скорости реакции
выражается уравнением
![]() .
Для реакций первого порядка концентрацииC1иC2могут быть выражены любыми пропорциональными
им величинами. В данной работе отношение
концентраций выражается через изменение
угла вращения плоскости поляризации
света, проходящего через раствор.
.
Для реакций первого порядка концентрацииC1иC2могут быть выражены любыми пропорциональными
им величинами. В данной работе отношение
концентраций выражается через изменение
угла вращения плоскости поляризации
света, проходящего через раствор.
Тростниковый сахар и глюкоза вращают плоскость поляризации вправо, а фруктоза – влево. Так как фруктоза даёт более интенсивное вращение влево, чем глюкоза – вправо, то по мере развития реакции угол вращения вправо больше, чем это соответствует убыли концентрации сахара, проходит через ноль и к концу реакции становится отрицательным. Угол вращения плоскости поляризации раствором сахара определяется с помощью поляриметра. Основными частями прибора являются поляризаторы 3 и 4 и анализатор 6. Поляризаторы и анализатор состоят из призм Николя, первый из двух или трёх, второй двух, шкалы и окуляра.
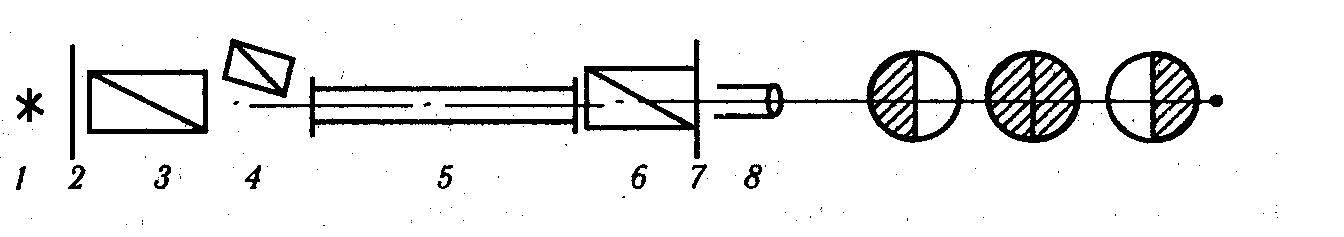
Рис. 9.1. Схема поляриметра: 1-источник света, 2 светофильтр, 3,4 – поляризаторы, 5 –трубка с раствором, 6 – анализатор, 7 – шкала, 8 - окуляр
Опыт начинают с определения “нулевого отсчёта”. Для этого поляриметрическую трубку наполняют дистиллированной водой, помещают её в поляриметр и, медленно поворачивая лимб, добиваются равномерного затемнения всего поля зрения. Делают отсчёт угла вращения с помощью нониуса. Если первый штрих нониуса оказался смещённым относительно нулевого штриха лимба по часовой стрелке, то поправку считают положительной. После этого воду из трубки выливают и покровные стёкла протирают мягкой тканью или фильтровальной бумагой. Взвешивают на технических весах 10 гсахара и растворяют его в 50млмерной колбе. Если раствор получится мутным, его фильтруют. В чистую и сухую колбу наливают пипеткой 25млотфильтрованного раствора и 25мл1.0нраствора соляной кислоты (ионы водорода являются катализатором). В момент смешения растворов пускают секундомер. Этот момент считают началом реакции инверсии. Закрывают один конец трубки покровным стеклом, прижимают его кольцом с нарезкой, трубку споласкивают небольшим количеством реакционной смеси и устанавливают её в поляриметр. Через 10минпосле начала реакции делают первый отсчёт угла вращения плоскости поляризации, затем отсчёты повторяют через 20, 40, 80 и 120минпосле начала реакции.
Закончив измерения, переливают раствор из трубки в колбу и оставляют его на 2…3 дня, либо нагревают до 60С и охлаждают до комнатной температуры. После этого делают последнее измерение угла, соответствующий практически полному окончанию реакции. Константу скорости вычисляют по уравнению:
![]() ,
(28)
,
(28)
где 1,2и– углы, измеренные к моментамt1иt2и по окончании реакции.
Результаты наблюдений и расчётов представляют по форме таблицы 2 и графика ln(i–) =f(t).
Таблица 2
Угол вращения плоскости поляризации при инверсии тростникового
сахара и кинетические параметры данного процесса
|
Время от начала реакции, мин |
i |
i– |
k |
kср |
kграф |
|
10 |
|
|
|
|
|
|
20 |
|
|
|
| |
|
30 |
|
|
|
| |
|
40 |
|
|
|
| |
|
60 |
|
|
|
| |
|
|
|
|
|
|
