
- •Химическая кинетика
- •Методы определения порядка рекации
- •Влияние температуры на скорость химических реакций
- •Катализ
- •Гомогенный катализ
- •Определение константы скорости реакции гидролиза сложного эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости инверсии тростникового сахара
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции омыления уксусноэтилового эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции второго порядка
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Определение энергии активации гомогенной реакции
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
- •Экспериментальная часть
- •Работа 6 а
- •Работа 6 б изучение вторичного солевого эффекта
- •Контрольные вопросы
- •Исследование скорости окисления металлов при высоких температурах Теоретическое введение
- •Экспериментальная часть
- •Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
- •Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
- •Изучение скорости мутаротации глюкозы Теоретическая часть
- •Последовательность выполнения работы
- •Литература
Работа 6 а
ИЗУЧЕНИЕ ПЕРВИЧНОГOСОЛЕВОГО ЭФФЕКТА
Первичный солевой эффект заключается в увеличении каталитического действия кислоты при прибавлении нейтральной соли, не имеющей общего аниона с катализирующей реакцию кислотой.
При постоянной начальной концентрации соляной кислоты проводят 5 опытов. Первый из них – без добавок соли, а последующие – с добавкой соли в таком количестве, чтобы концентрация ее в реакционной смеси изменялась в пределах от 0,025 до 0,2 N. Полученные опытные и расчетные данные помещают в табл. 1.
Строят зависимости:
1) n![]() =f(
=f(![]() ),
),
2) Константы скорости реакции от концентрации соли.
Работа 6 б изучение вторичного солевого эффекта
Вторичный солевой эффект заключается в том, что при добавлении в реакционную смесь соли катализирующей кислоты каталитическое действие последней может сначала уменьшаться, а затем возрастать с увеличением концентрации соли.
Катализатором здесь служит 1,0 Nуксусная кислота, добавками – уксуснокислый натрий. При постоянной температуре проводят 8-10 опытов, причем максимальная концентрация соли в реагирующей смеси не должна превышать 0,2 N. Несколько опытов должны быть сделаны в пределах до 0,02Nконцентрации соли, так как характерный для изучаемого эффекта минимум наблюдается примерно при 0,01Nсоли. Полученные данные заносят в табл. 1, а также представляют в виде графика.
Контрольные вопросы
Почему скорость реакции иодирования ацетона не зависит от концентрации йода?
Получите соотношение (5) интегрированием уравнения (4).
Какие координаты, кроме предложенных (6), можно использовать для графической проверки уравнения (5)?
Как влияет исходная концентрация реагентов на ход графиков
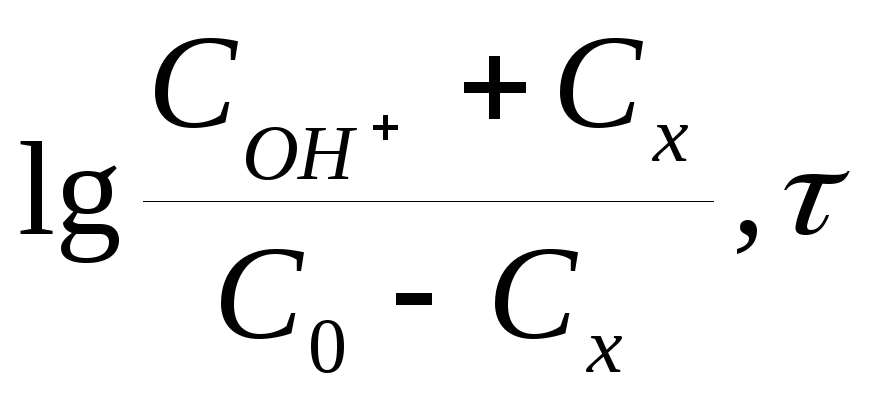 ?
?
5. Какие соли необходимо добавлять в реакционную смесь для изучения солевых эффектов?
Лабораторная работа 7
Исследование скорости окисления металлов при высоких температурах Теоретическое введение
Примером газовой коррозии металлов может служить окисление последних при высоких температурах. При комнатной температуре окисление металлов чаще всего ограничивается потускнением или образованием тонких пленок. Вследствие малой диффузии кислорода к поверхности металла при таких температурах толщина этих пленок практически не увеличивается. Особое положение в условиях химических производств имеет газовая коррозия при высоких температурах. Такая коррозия является равномерной, т. к. распространяется вглубь металла почти одинаково по всей поверхности, а образующиеся пленки из продуктов коррозии имеют одинаковую толщину по всей площади, подвергающейся коррозии.
Скорость газовой коррозии оценивается по привесу с квадратного метра поверхности в единицу времени или по глубине коррозии.
При повышении температуры скорость коррозии взрастает, т. к. увеличивается скорость диффузии и химических процессов. Вследствие этого пленки продуктов коррозии утолщаются. Увеличение толщины пленки на разных металлах протекает по различным законам: прямолинейному, параболическому и логарифмическому. Данное обстоятельство обусловливается главным образом природой образующихся оксидов, а также целостностью покрытия. У металлов, на которых при окислении не образуется защитная пленка, скорость роста остается постоянной. Толщину ее рассчитывают на основании формулы
![]() , (39)
, (39)
т. е.
![]() , (40)
, (40)
где
![]() - толщина слоя продукта коррозии,
- толщина слоя продукта коррозии,![]() - коэффициент скорости процесса,
- коэффициент скорости процесса,![]() – движущая сила коррозии, А – постоянная
интегрирования.
– движущая сила коррозии, А – постоянная
интегрирования.
Константа интегрирования определяет толщину пленки в начальный момент окисления, т. е. τ = 0. Если окисление начинается на чистой поверхности, то А = 0.
Ряд металлов, применяемых в химической технологии, окисляется по параболическому закону, например, металлы, на которых в результате химической коррозии получаются сплошные пленки. В этом случае процесс тормозится диффузией агентов через пленку и по мере ее роста коррозия замедляется.
П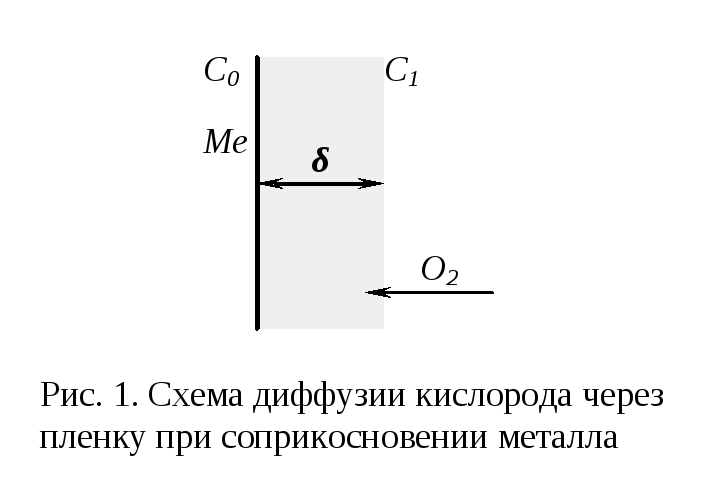 редставим
сплошную пленку толщиной
редставим
сплошную пленку толщиной![]() ,
находящуюся на поверхности окисляющегося
металла (рис. 1). Для этого случая имеем
соотношение
,
находящуюся на поверхности окисляющегося
металла (рис. 1). Для этого случая имеем
соотношение
![]() , (41)
, (41)
где G– количество
диффундирующего вещества, τ – время,D– коэффициент диффузии,![]() - градиент концентрации,F– площадь окисления.
- градиент концентрации,F– площадь окисления.
Если принять, что в процессе окисления
устанавливается стационарный режим
диффузии, т. е. не происходит накопления
диффундирующего вещества в каком–либо
сечении пленки, то производная
![]() заменяется соотношением
заменяется соотношением![]()
![]() .
Здесь С0– концентрация кислорода
на внешней поверхности пленки на границе
с воздухом, С1– концентрация
кислорода на внутренней поверхности
пленки на границе с металлом. Тогда
скорость диффузии
.
Здесь С0– концентрация кислорода
на внешней поверхности пленки на границе
с воздухом, С1– концентрация
кислорода на внутренней поверхности
пленки на границе с металлом. Тогда
скорость диффузии
![]() (42)
(42)
для единичной поверхности пропорциональна разности концентраций кислорода и обратно пропорциональна толщине слоя.
Примем, что на корродируемом металле уже имеется защитная пленка, а процесс идет в диффузионной области, и весь кислород, диффундируя через пленку, не накапливается, т. е. немедленно вступает в реакцию. Для такого случая скорость роста пленки (Uкор) может быть равна скорости диффузии кислорода (UD)
![]() . (43)
. (43)
При постоянных условиях окисления (парциальное давление кислорода и температура процесса равны const, например, при воздействии воздуха, нагретого до определенной температуры).
![]() (44)
(44)
или после интегрирования
![]() . (45)
. (45)
В некоторых случаях, например при наличии в растущей пленке трещин (из-за нагревания или охлаждения), а также при сравнительно невысоких температурах, коррозия металлов протекает по логарифмическому закону
![]() (46)
(46)
или
![]() . (47)
. (47)
При увеличении температуры скорость окисления возрастает. Это происходит потому, что с ростом температуры увеличивается скорость диффузии кислорода и константа скорости окисления в соответствии с уравнением Аррениуса
![]() . (48)
. (48)
П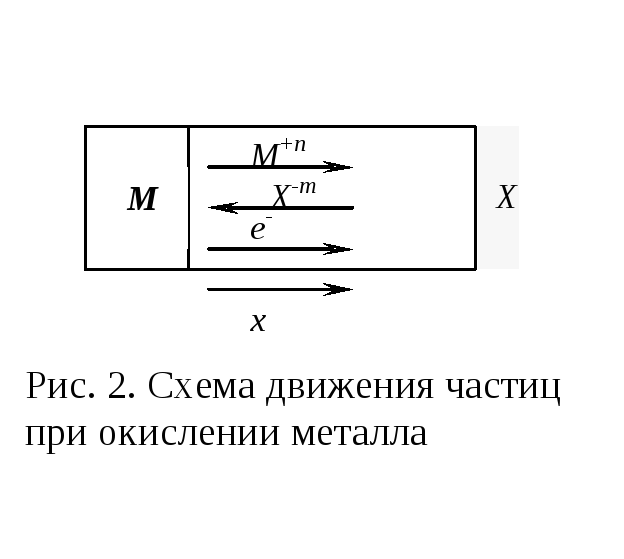 еренос
вещества через слой продукта реакции
окисления – окалину осуществляется
путем независимого движения заряженных
частиц: ионов (катионовM+nX-m)
и электронов е-. Согласно схеме,
изображенной на рис. 2, катионы и электроны
движутся в одном направлении – от
границы окалины с металлом к границе с
неметаллом, анионы – в противоположном.
еренос
вещества через слой продукта реакции
окисления – окалину осуществляется
путем независимого движения заряженных
частиц: ионов (катионовM+nX-m)
и электронов е-. Согласно схеме,
изображенной на рис. 2, катионы и электроны
движутся в одном направлении – от
границы окалины с металлом к границе с
неметаллом, анионы – в противоположном.
Процесс переноса через слой окалины является лимитирующей стадией процесса окисления: переход ионов или электронов через поверхность раздела фаз протекает без затруднений, поэтому на межфазных границах существует термодинамическое равновесие.
