
- •Химическая кинетика
- •Методы определения порядка рекации
- •Влияние температуры на скорость химических реакций
- •Катализ
- •Гомогенный катализ
- •Определение константы скорости реакции гидролиза сложного эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости инверсии тростникового сахара
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции омыления уксусноэтилового эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции второго порядка
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Определение энергии активации гомогенной реакции
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
- •Экспериментальная часть
- •Работа 6 а
- •Работа 6 б изучение вторичного солевого эффекта
- •Контрольные вопросы
- •Исследование скорости окисления металлов при высоких температурах Теоретическое введение
- •Экспериментальная часть
- •Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
- •Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
- •Изучение скорости мутаротации глюкозы Теоретическая часть
- •Последовательность выполнения работы
- •Литература
Отчет по работе
должен содержать:
-теоретическое обоснование экспериментальной части работы и методику эксперимента,
- измеренные на опыте промежутки времени,
-график зависимости:
![]() ,
константа скорости реакция - обратная
температура,
,
константа скорости реакция - обратная
температура,
-расчёт константы скорости,
- мотивированное обоснование ошибки измерения всех величин.
лабораторная работа 5
Определение энергии активации гомогенной реакции
Цель работы: определить константу скорости реакции окисления йодистого калия персульфатом калия (или натрия) при трех температурах и рассчитать энергию активации из графической зависимости.
ПРИБОРЫ И РЕАКТИВЫ: штатив с пробирками, пипетки на 2 мл, термостаты; йодистый калий 0,1н; персульфат калия или натрия 0,05н; тиосульфат 0,01н.
Теоретическое обоснование
Реакцию окисления иодид-иона персульфатом калия (или натрия) относят к реакциям второго порядка, кинетическое уравнение которых можно записать так:
W=kCACB,
где СА-концентрация йодистого калия, СВ- концентрация персульфата калия (или натрия).
Если измерять скорость реакции в
начальный период ее протекания, когда
начальные концентрации реагирующих
веществ еще не успели существенно
измениться, то изменение концентрации
одного из реагентов ΔСАмало, и, следовательно, производную от
концентрации по времени можно заменить
отношением конечных приращений:
![]() .
Тогда кинетическое уравнение для
описания процесса можно представить в
виде выражения:
.
Тогда кинетическое уравнение для
описания процесса можно представить в
виде выражения:
![]() .
.
Если C0,A=C0,B ;CA=const(это означает, что в разных опытах начальные концентрации реагентов берутся одинаковыми и определяется промежуток времениΔt, за которое концентрация вещества А изменяется на одну и ту же величинуΔCA ), тоk~1/Δtи интегральная форма уравнения Аррениуса принимает вид:
![]() .
.
Таким образом, энергию активации можно найти из графика, построенного в координатах ln(1/Δt) – 1/Т, по формулеΔE=-Rtgα.
Методика эксперимента
В три пробирки (на половину объёма) наливают йодистый калий, в три другие пробирки – персульфат (рисунок). В шесть пробирок наливают по 2 млтиосульфата натрия (по две на каждую температуру) и несколько капель крахмала, после чего помещают их в термостаты с разной температурой (задаётся преподавателем).
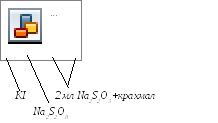
Рис. 2. Набор пробирок для осущест-
вления кинетического эксперимента
Далее готовят реакционную смесь, начиная с меньшей температуры. Пипеткой добавляют в пробирку с тиосульфатом натрия 2 млперсульфата и 2млйодистого калия. В момент добавления йодистого калия отмечают астрономическое время начала реакции в минутах и секундах. То же самое проделывают с более высокими температурами. В момент появления синей окраски еще раз отмечают астрономическое время и рассчитывают временной промежутокΔt, за который концентрация реагирующих веществ изменяется на одну и ту же величину.
Усредняют временной промежуток Δtиз двух пробирок для каждой температуры и строят график зависимостиln(1/Δt)–1/Т, из которого по формулеΔE=-Rtgα рассчитывают энергию активации реакции.
Отчет по работе
должен содержать:
-теоретическое обоснование экспериментальной части работы и методику эксперимента,
-экспериментально измеренные промежутки времени и их усредненные значения,
-график зависимости :
![]() ,
,
-расчёт энергии активации,
- мотивированное обоснование ошибки измерения всех величин.
Лабораторная работа 6
