
- •Химическая кинетика
- •Методы определения порядка рекации
- •Влияние температуры на скорость химических реакций
- •Катализ
- •Гомогенный катализ
- •Определение константы скорости реакции гидролиза сложного эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости инверсии тростникового сахара
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции омыления уксусноэтилового эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции второго порядка
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Определение энергии активации гомогенной реакции
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
- •Экспериментальная часть
- •Работа 6 а
- •Работа 6 б изучение вторичного солевого эффекта
- •Контрольные вопросы
- •Исследование скорости окисления металлов при высоких температурах Теоретическое введение
- •Экспериментальная часть
- •Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
- •Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
- •Изучение скорости мутаротации глюкозы Теоретическая часть
- •Последовательность выполнения работы
- •Литература
Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
Перекись водорода в водных растворах самопроизвольно медленно разлагается по уравнению:
Н2О2 Н2О +0,5О2.
Реакция заметно протекает при комнатной температуре только в присутствии катализаторов. Ими могут быть некоторые катионы и анионы в растворе, а также ряд твердых веществ. В соответствии с этим катализ разложения Н2О2подразделяется на гомогенный и гетерогенный.
ГОМОГЕННО‑КАТАЛИТИЧЕСКИЙ РАСПАД Н2О2
В ПРИСУТСТВИИ ИОНОВ Сr2О72-
Разложение перекиси водорода в растворе под действием ионов Сr2О72-происходит в две стадии. В первой стадии реакции обратимо образуется промежуточное соединение:
2Н2О2 + Сr2О72- Cr2О92- + 2Н2О,
которое далее необратимо распадается с выделением кислорода и исходного иона Сr2О72-.
Полагая, что лимитирующей стадией процесса является относительно медленный распад промежуточного соединения, общую скорость процесса можно считать пропорциональной концентрации промежуточного вещества:
![]() , (60)
, (60)
где R– константа скорости второй стадии реакции. Концентрацию промежуточного вещества можно найти, используя константу равновесия первой стадии:
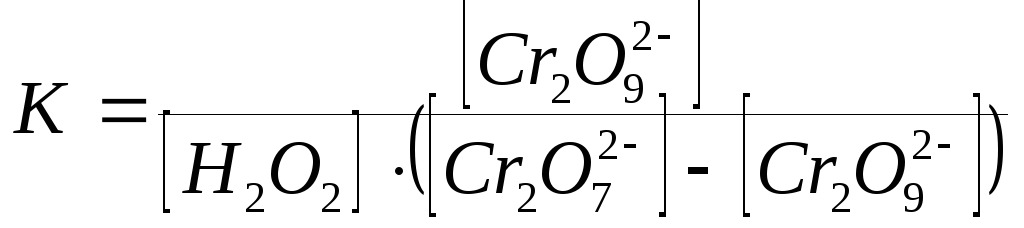 , (61)
, (61)
где К – константа равновесия; [Cr2O72-] – концентрации катализатора до начала реакции; [Cr2O72-] – [Cr2O92-] – концентрация катализатора при равновесии. Вода находится в большом избытке, и ее концентрацию можно считать постоянной.
Из уравнения (2) получаем:
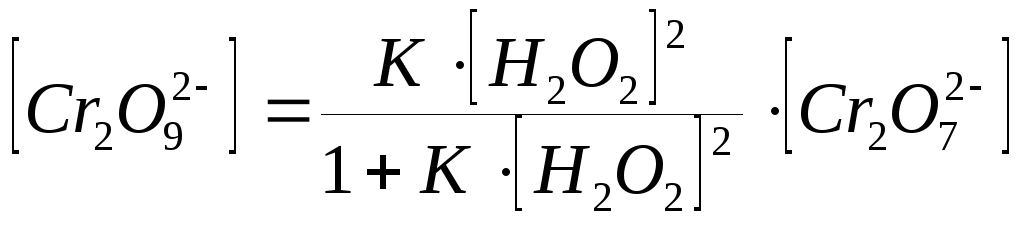 , (62)
, (62)
откуда
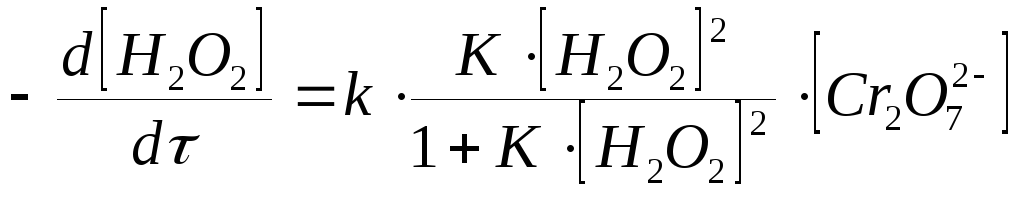 . (63)
. (63)
Из последнего уравнения следует, во-первых, что скорость процесса пропорциональна начальной концентрации катализатора и, во-вторых, что в общем случае порядок реакции дробный и может изменяться от 0-го до 2-го. Действительно, если равновесие сдвинуть в сторону образования промежуточного продукта, т.е. К[H2O2] > 1, порядок реакции равен нулевому:
![]() .
(64)
.
(64)
Когда К[H2O2] < 1, т.е. равновесие сдвинуто в сторону исходного вещества,
![]() (65)
(65)
и порядок реакции будет равен 2.
Поскольку сдвиг равновесия в ту или иную сторону зависит от температуры, то и порядок реакции изменяется с температурой. Уравнение (4) можно преобразовать в линейную форму; взяв обратное значение скорости:
 . (66)
. (66)
Построив график в координатах (d[H2O2]/d)-1, [H2O2]2, по тангенсу угла наклона прямой можно найти произведениеkK, а по отрезку на оси ординат - значениеk.
Таким образом, из кинетического опыта можно определить константу равновесия и константу скорости реакции.
ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИЙ РАСПАД Н2О2
НА АКТИВИРОВАННОМ УГЛЕ
Реакция разложения Н2О2на активированном угле идет большей частью по первому или близкому к первому (0,7-1,2) порядку. Поэтому для оценки скорости реакции можно пользоваться кинетическим уравнением первого порядка
![]() . (67)
. (67)
Так как изменение концентрации Н2О2прямо пропорционально количеству выделяющегося кислорода, то при газометрическом измерении скорости реакции константу скорости удобнее определить через объем выделившегося О2:
![]() , (68)
, (68)
где V- общий объем выделившегося кислорода;V- объем О2, выделившийся к моменту времени.
Экспериментальная часть
Одним из наиболее распространенных методов изучения кинетики разложения перекиси водорода является газометрический метод, который используется в нашей работе в обоих случаях.
 Установка
представлена на рис. 5.
Установка
представлена на рис. 5.
Рис. 5. Установка для изучения кинетики каталитических реакций
При снятии отсчетов по бюретке (2) необходимо приводить к одному уровню мениски жидкости в бюретке и уравнительной склянке (3), перемещая последнюю. Перед опытом необходимо проверить установку на герметичность. Для этого опускают уравнительную склянку ниже уровня бюретки. Уровень воды в бюретке при этом опустится и установится на некотором делении. Если это положение не изменится в течение 3 мин, установку можно считать герметичной. В противном случае уровень воды в бюретке будет непрерывно расти.
В работе следует изучить реакцию распада перекиси водорода на жидком и твердом катализаторах.
1. Цель данного раздела - получение зависимости константы скорости и константы равновесия реакции от концентрации катализатора и нахождение порядка реакций.
Нужно приготовить раствор перекиси водорода с концентрацией в пределах 0,1-0,2 (150-200 мл). Точная концентрация Н2О2определяется титрованием перманганатом калия. Для этого наливают пипеткой 2-3 мл рабочего раствора (1N) и 1-2 мл 20-процентного раствора Н2SO4. Титруют 0,1Nраствором КМnO4до появления слабо-розового окрашивания. При этом протекает реакция
2MnO4- + 6H+ + 5H2O2 2Mn2+ + 8H2O + 5O2.
Знание точной концентрации раствора Н2О2необходимо для сравнения опытного конечного объема выделившегося кислорода и теоретического, которое можно рассчитать по уравнению Клайперона-Менделеева с учетом давления насыщенного пара воды при температуре опыта. В каждом опыте используют одно и то же количество раствора перекиси водорода в пределах 20-25 мл. Проводят 2-3 опыта, варьируя концентрацию раствора катализатора К2Сr2О7в пределах 0,05-0,2N, сохраняя одинаковый добавляемый объем 3 мл. Опытные данные вносят в табл. 5 и представляют в виде графиков:
кинетические кривые VO2=f() иCH2O2=f() для всех концентраций катализатора. По этим кривым графическим дифференцированием определяют скорость реакции;
график зависимости 1/СН2О2= f(1/С2Н2О2) для определенияkи К;
зависимости k= f(ССr2О72-).
2. Оттитровывают точную концентрацию 1Nраствора Н2О2. В колбочку заливают 20 мл этого раствора, затем засыпают навеску активированного угля (0,5-1,0 г), быстро закрывают пробкой на отводящем шланге, одновременно включают секундомер, начинают интенсивно встряхивать реакционный сосуд (это производят в течение всего опыта с целью исключить влияние процесса диффузии на кинетику реакции) и приступают к отсчетам объема выделившегося кислорода по шкале бюретки.
Опытные данные заносят в табл. 5 и представляют графически:
кинетические кривые VО2= f() и СН2О2= f();
графики для определения порядков реакции в координатах Lg=f(LgC) по графам (1) и (4).
Для получения воспроизводимых результатов рекомендуется все опыты дублировать два- три раза.
Контрольные вопросы
1. Почему катализатор ускоряет реакцию?
По какой причине тип катализатора влияет на скорость катализируемой реакции?
Каковы механизмы гомогенно- и гетерогенно-каталитических процессов?
Каков режим протекания гетерогенно-каталитического разложения Н2О2? Есть ли возможность изменить его?
Изобразите кривые изменения потенциальной энергии в каталитическом процессе.
Охарактеризуйте как можно полнее изученные каталитические реакции.
Лабораторная работа 11
