
- •Химическая кинетика
- •Методы определения порядка рекации
- •Влияние температуры на скорость химических реакций
- •Катализ
- •Гомогенный катализ
- •Определение константы скорости реакции гидролиза сложного эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости инверсии тростникового сахара
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции омыления уксусноэтилового эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции второго порядка
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Определение энергии активации гомогенной реакции
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
- •Экспериментальная часть
- •Работа 6 а
- •Работа 6 б изучение вторичного солевого эффекта
- •Контрольные вопросы
- •Исследование скорости окисления металлов при высоких температурах Теоретическое введение
- •Экспериментальная часть
- •Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
- •Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
- •Изучение скорости мутаротации глюкозы Теоретическая часть
- •Последовательность выполнения работы
- •Литература
Методы определения порядка рекации
– Экспериментально полученные значения скоростей реакции r1,r2,r3… для соответствующих концентраций С1, С2, С3… наносят на график, построенный в координатах: скорость – концентрация, взятая в 1-ой, 2-ойи т.д. степени и устанавливают, при какой степени точки укладываются на прямой линии. Эта степень и будет искомым порядком реакции. Способ неприменим при дробном порядке.
– Уравнение основного постулата
химической кинетики
![]() логарифмируют
логарифмируют![]() и, подставляя экспериментальные
результаты, строят график, на котором
по оси ординат откладываютlnr,
а по оси абсциссlnC.
Угловой коэффициент прямой и будет
искомым порядком реакции. Способ применим
для любого порядка, целого или дробного.
и, подставляя экспериментальные
результаты, строят график, на котором
по оси ординат откладываютlnr,
а по оси абсциссlnC.
Угловой коэффициент прямой и будет
искомым порядком реакции. Способ применим
для любого порядка, целого или дробного.
– Используя время периода полураспада,
можно показать, что любая реакция
характеризуется выражением:
![]() ,
где А – постоянная для данной реакции
величина. Если известен период полураспада
для двух различных начальных концентраций
,
где А – постоянная для данной реакции
величина. Если известен период полураспада
для двух различных начальных концентраций![]() и
и![]() ,
то
,
то
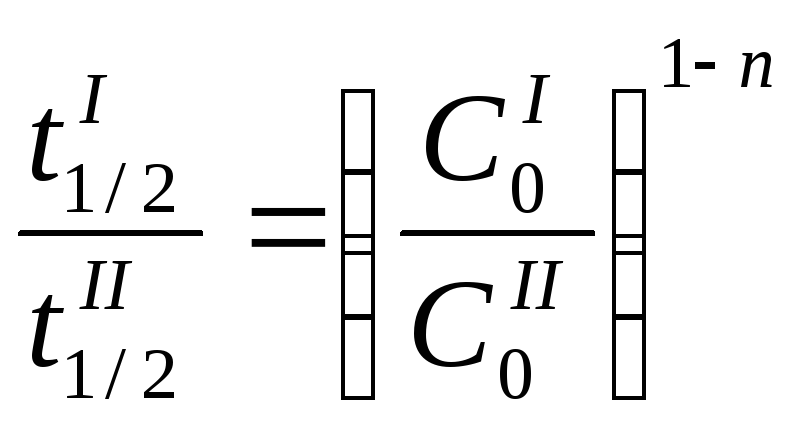 ,
(11)
,
(11)
откуда и определяется n.
Ясно, что этот способ неприменим для
реакции 1-гопорядка, т.к. для неё![]() не зависит от начальной концентрации
и соотношение (11) обращается в тождество.
не зависит от начальной концентрации
и соотношение (11) обращается в тождество.
Влияние температуры на скорость химических реакций
С повышением температуры скорость реакции, как правило, возрастает, а концентрация веществ от температуры не зависит, следовательно, повышение скорости происходит за счет увеличения константы скорости. Количественно эта зависимость определяется основным уравнением химической кинетики Аррениуса:
![]() , (12)
, (12)
где A– предэкспоненциальный множитель, постоянный для конкретной реакции;E– энергия активации реакции, которая означает избыток энергии сверх средней, которым должны обладать молекулы, чтобы при столкновении между ними могло произойти химическое взаимодействие.
Таким образом, энергия активации это
энергетический барьер, который должны
преодолеть взаимодействующие частицы.
Очевидно, чем выше этот барьер, тем
меньше активных, т.е. способных к
взаимодействию частиц и скорость
процесса будет ниже. При значительной
величине Eможет
случиться, что в течение длительного
времени не найдется ни одной пары частиц,
способных к взаимодействию; в таком
случае говорят о заторможенности
процесса по кинетическим причинам. Так
как энергия активации есть избыток
энергии сверх средней, то по своему
смыслу она не может быть отрицательной
(![]() )
и если она приближается к нулю, то,
следовательно, для взаимодействия не
требуется избытка энергии и большинство
молекул, обладающих средним запасом
энергии, будут активными. В этом случае
скорость процесса максимальна и
практически не будет зависеть от
температуры. Энергия активация есть
вторая важная характеристика процесса.
Логарифмируя уравнение 3 и дифференцируя
поТ(при условии, чтоЕиA
не зависят от температуры), получим:
)
и если она приближается к нулю, то,
следовательно, для взаимодействия не
требуется избытка энергии и большинство
молекул, обладающих средним запасом
энергии, будут активными. В этом случае
скорость процесса максимальна и
практически не будет зависеть от
температуры. Энергия активация есть
вторая важная характеристика процесса.
Логарифмируя уравнение 3 и дифференцируя
поТ(при условии, чтоЕиA
не зависят от температуры), получим:
![]() .
(13)
.
(13)
Поскольку Е0, то с повышением температуры константа скорости любой реакции возрастает, причем тем более интенсивно, чем выше величинаЕ. ПриЕ 0,k Aтаким образом скорость реакции перестает зависеть от температуры.
Интегрируя (13) при Е= сonst, получим выражение
![]() .
(14)
.
(14)
В координатах lnk
– 1/Tэта зависимость
выражается прямой, тангенс угла наклона
которой позволяет определить величину
Е из экспериментальных данных.
Интегрирование выражения 4 в пределах
отТ1доТ2
приводит к соотношению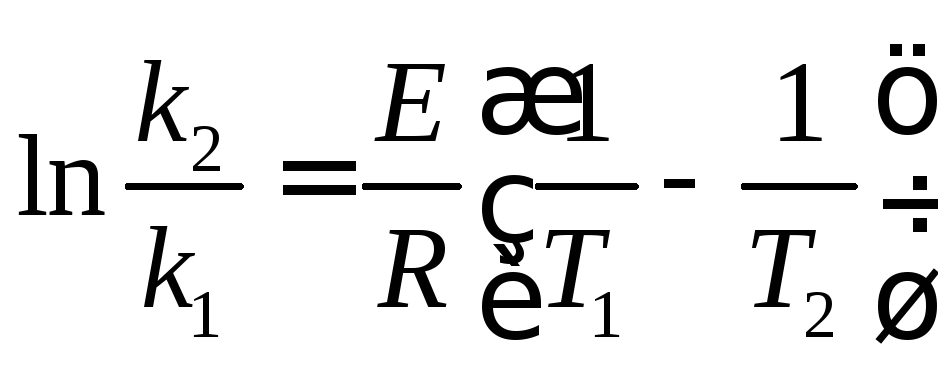 ,
из которого находят энергию активации
процесса:
,
из которого находят энергию активации
процесса:
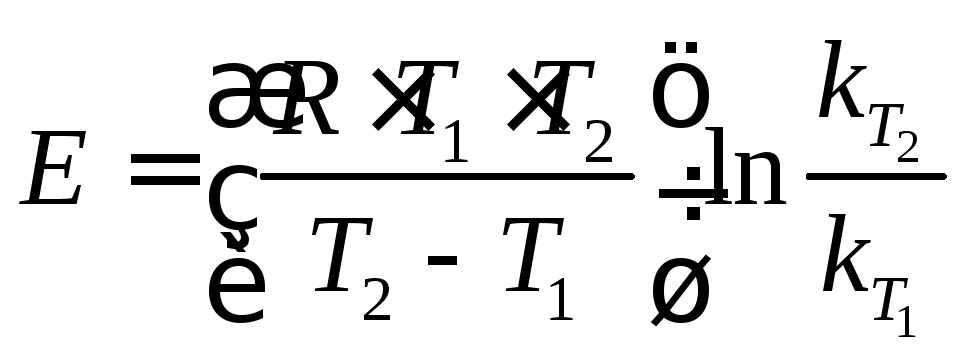 .
(15)
.
(15)
Выражение (15) позволяет вычислить энергию активации по двум значениям констант скоростей k1иk2, полученных при двух температурахТ1иТ2.
