
- •Химическая кинетика
- •Методы определения порядка рекации
- •Влияние температуры на скорость химических реакций
- •Катализ
- •Гомогенный катализ
- •Определение константы скорости реакции гидролиза сложного эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости инверсии тростникового сахара
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции омыления уксусноэтилового эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции второго порядка
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Определение энергии активации гомогенной реакции
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
- •Экспериментальная часть
- •Работа 6 а
- •Работа 6 б изучение вторичного солевого эффекта
- •Контрольные вопросы
- •Исследование скорости окисления металлов при высоких температурах Теоретическое введение
- •Экспериментальная часть
- •Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
- •Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
- •Изучение скорости мутаротации глюкозы Теоретическая часть
- •Последовательность выполнения работы
- •Литература
Изучение скорости мутаротации глюкозы Теоретическая часть
При стоянии свежеприготовленных растворов – или – глюкозы в них накапливается второй изомер и постепенно устанавливается равновесие между этими стереоизомерами:
–глюкоза –глюкоза
При этом удельное вращение плоскости поляризации светового потока изменяется (при 20°С для –глюкозы +110,1и для–глюкозы +19,3°, для смеси +52,5°). Это превращение ускоряется в присутствии кислот и особенно оснований. Поскольку реакция обратима, наблюдаемая константа скорости реакции, рассчитываемая по уравнению реакции 1-го порядка, является суммой констант скорости прямой и обратной реакций, т. е.k=k1+k–1.
Скорость реакции может быть изучена без катализатора и с катализатором и определена по изменению угла вращения плоскости поляризации светового потока при помощи поляриметра.
Последовательность выполнения работы
Отвесить на технических весах две навески по 5 г кристаллической глюкозы. Одну из них поместить в мерную колбу вместимостью 50 мл. Отметив время, быстро довести объем колбы водой до метки, перемешать и отметить момент полного растворения глюкозы. Время – среднее между началом и концом растворения глюкозы – принять за момент начала реакции.
Примечание. Если скорость реакции изучается при температуре, отличающейся от комнатной, то вода, в которой растворяется глюкоза, должна быть предварительно нагрета до температуры опыта.
Раствор, если он мутный, отфильтровать и налить в поляриметрическую трубку, предварительно дважды сполоснув ее этим же раствором. Затем измерить углы вращения плоскости поляризации. После первого измерения перенести вторую навеску в 50–миллилитровую мерную колбу, растворить ее в соляной кислоте заданной концентрации и довести водой объем раствора в колбе до метки. За начало реакции принимается время, среднее между началом и концом растворения глюкозы. Измерения углов вращения плоскости поляризации для смеси с катализатором чередуют с измерениями для смеси, в которой идет самопроизвольная мутаротация.
Для определения конечного угла вращения плоскости поляризации часть раствора, оставшегося после заполнения трубки, поместить в термостат при 40°С, где и выдержать в течение всего опыта. По окончании измерений определить угол вращения плоскости поляризации оставшегося раствора, охладив его до температуры опыта. Начальный угол вращения плоскости поляризации раствора0рассчитать экстраполяцией зависимостиlg(t–) на нулевое время реакции. Обработку полученных данных произвести в той же последовательности, как и в работе 2. Затем вычислить константы скорости реакции без катализатора и в присутствии катализатора по уравнению
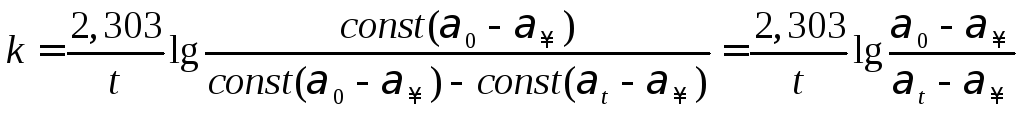
Используя опытные данные, вычислить по уравнению k=k0+ac,гдеkиk0– константа скорости реакции в присутствии и отсутствии катализатора, соответственно,a– каталитический коэффициент,c– концентрация катализатора каталитический коэффициент, предполагая, что действие катализатора пропорционально его концентрации.
Вычислить и аналитически, и графическим путем, как это средние константы скорости k0 иk. Результаты наблюдений записать в таблицу 6.
Таблица 6
|
Мутаротация в отсутствие катализатора |
Мутаротация в присутствии катализатора | ||||||||||
|
Время измерения |
Промежуток времени от начала реакции, мин |
t |
t – |
k0 (с указанием размерности) |
k0,ср |
Время измерения |
Промежуток времени от начала реакции, мин |
t |
t – |
k0 (с указанием размерности) |
k0,ср |
|
|
|
|
|
|
|
|
|
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ К экспериментальным
работам
1. Скорость гомогенной химической реакции и закон действия масс.
2. Константа скорости химической реакции, её физический смысл. Связь между константой равновесия и константами скоростей прямой и обратной реакции.
3. Влияние температуры на скорость химической реакции. Основное уравнение химической кинетики Аррениуса и его анализ. Энергия активации и её сущность.
4. Показать графически или на основе уравнения Аррениуса связь, существующую между тепловым эффектом всей реакции и энергиями активации прямой и обратной реакции.
5. Экспериментальные методы определения энергии активации.
6. Молекулярность и порядок реакции. Методы экспериментального определения порядка реакции.
7. Характеристика реакций 1-го и 2-го порядков.
8. Особенности обратимых, параллельных и последовательных реакций.
9. Почему бимолекулярные реакции (9.7) и (9.9) протекают по механизму реакций первого порядка?
10. Почему в работах 21 и 23 титрование рабочей смеси производят в предварительно охлаждённой воде?
11. Показать, почему в работе 21 количество неизрасходованного эфира пропорционально разности объемов барита, израсходованных при последнем титровании и при титровании в момент времени t.
12. Какой свет называют поляризованным? Что называют плоскостью поляризации? Назначение поляризатора и анализатора в поляриметре.
13. Какому положению главных осей в призмах Николя соответствует равномерное затемнение поля зрения?
14. Дать характеристику оптической активности участников реакции инверсии сахара. Показать, почему остаточная концентрация сахара в смеси пропорциональна разности (i-).
15. Исходя из уравнения (9.12), получить уравнение (9.12I). Объяснить осуществленную в уравнении (9.12II) замену концентраций соответствующими объемами соляной кислоты, израсходованными на титрование.
16. Сказывается ли на величине энергии активации, определяемой в работе 23, замена истинной константы скорости (К) условной (К)? Как можно было бы пересчитать К на действительное значение константы скорости К?
