
- •Химическая кинетика
- •Методы определения порядка рекации
- •Влияние температуры на скорость химических реакций
- •Катализ
- •Гомогенный катализ
- •Определение константы скорости реакции гидролиза сложного эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости инверсии тростникового сахара
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции омыления уксусноэтилового эфира
- •Методика эксперимента
- •Отчет по работе
- •Определение константы скорости реакции второго порядка
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Определение энергии активации гомогенной реакции
- •Теоретическое обоснование
- •Методика эксперимента
- •Отчет по работе
- •Изучение кинетики реакций второго порядка на примере реакции иодирования ацетона в кислой среде Теоретическое введение
- •Экспериментальная часть
- •Работа 6 а
- •Работа 6 б изучение вторичного солевого эффекта
- •Контрольные вопросы
- •Исследование скорости окисления металлов при высоких температурах Теоретическое введение
- •Экспериментальная часть
- •Изучение кинетики испарения жидкости и диффузии ее паров в воздухе Теоретическое введение
- •Изучение кинетики каталитических реакций на примере разложения перекиси водорода Теоретическое введение
- •Изучение скорости мутаротации глюкозы Теоретическая часть
- •Последовательность выполнения работы
- •Литература
Катализ
Катализ – изменение скорости химической реакции в присутствии катализаторов. Катализ называютположительным, если скорость реакции увеличивается, иотрицательным, если скорость уменьшается. Пригомогенном катализе реагенты и катализатор находятся в одной фазе, пригетерогенном катализе – в разных фазах.
Катализатор – вещество, участвующее в реакции и изменяющее ее скорость, но остающееся неизменным после того, как химическая реакция заканчивается. Катализатор, замедляющий реакцию, называютингибитором. Биологические катализаторы белковой природы называютферментами.
Механизм действия катализаторов состоит
в том, что они образуют промежуточные
соединения с исходными веществами и
тем самым изменяют путь реакции, причем
новый путь характеризуется другой
высотой энергетического барьера, т.е.
энергия активации изменяется по сравнению
с некатализируемой реакцией (рис. 1). В
случае положительного катализа она
уменьшается, а отрицательного –
увеличивается. Если изменение энергии
активации составляет ∆E =Eнекат–Eкат, а предэкспоненциальный
множитель в уравнении Аррениуса (3) при
добавлении катализатора изменяется
незначительно, то отношение констант
скорости катализируемой и некатализируемой
реакций будет примерно равно: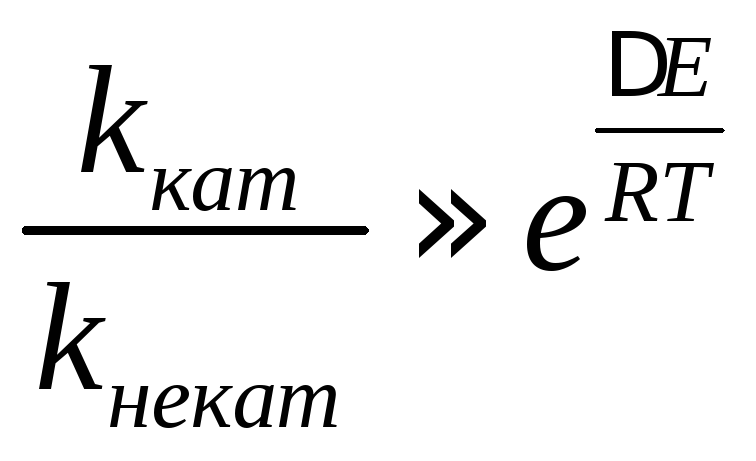 .
.
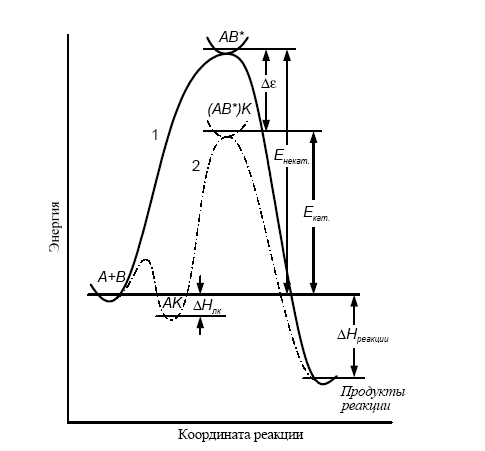
Рис. 1.Энергетические профили гомогенной реакции: сплошная кривая соответствует реакции без катализатора, пунктирная – каталитической реакции. Тепловой эффект каталитической реакции – такой же, как и в отсутствие катализатора
Например, при ∆E ~ 40 кДж⋅моль–1иT = 300 К, скорость реакции увеличится в 9⋅106раз.
Так как изменение термодинамических функций в химических реакциях определяется только состоянием реагентов и продуктов и не зависит от промежуточных стадий (закон Гесса), то катализатор не может повлиять ни на тепловой эффект реакции, ни на энергию Гиббса, ни на константу равновесия (в случае обратимой реакции). В последнем случае катализатор изменяет лишь время достижения равновесного состояния, но не его термодинамические характеристики.
Гомогенный катализ
Простейшая схема гомогенного катализа включает обратимое образование промежуточного комплекса катализатора (K) с одним из реагирующих веществ A,Bи превращение этого комплекса в продукты реакцииC,Dс высвобождением катализатора:
![]()
![]()
Применение квазистационарного приближения к этой схеме (при условии k2>>k1) позволяет выразить скорость образования продуктов через концентрации реагентов и катализатора:
![]() .
(16)
.
(16)
Это уравнение лежит в основе кинетики гомогенно-каталитических реакций. Из него видно, что скорость реакции прямо пропорциональна концентрации катализатора, что хорошо согласуется с опытными данными для многих реакций. Многие гомогенные реакции катализируются кислотами или основаниями. Реакции, катализируемые ионами H+(H3O+) или OH–, относят кспецифическому кислотному илиосновному катализу. Простейшие механизмы этих реакций включают обратимое взаимодействие субстрата (S) с каталитической частицей и превращение образующегося комплекса в продукт (P):
специфический кислотный катализ:
![]() ;
;
специфический
основной катализ:
![]() .
.
Специфический кислотный катализ характерен для реакций дегидратации спиртов и кето-енольной таутомеризации, а специфический основной катализ – для альдольной конденсации. Гидролиз сложных эфиров ускоряется как в кислой, так и в щелочной среде. Скорость каталитической реакции пропорциональна концентрации протонированной формы субстрата:
r=k2[SH+]. (17)
В квазиравновесном приближении эту концентрацию можно выразить через константу основности субстрата:
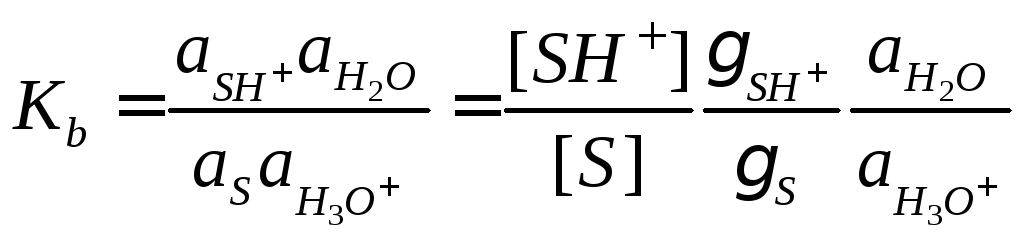 ,
(18)
,
(18)
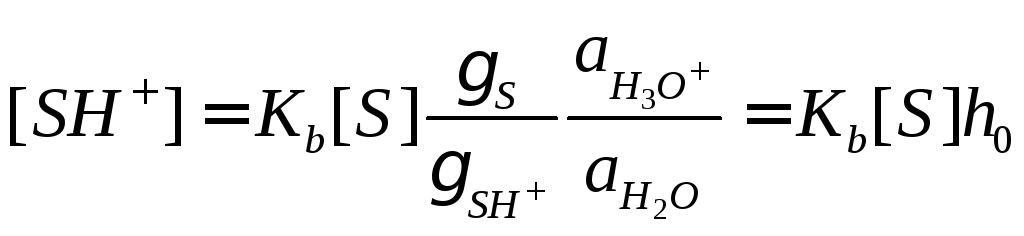 ,
(19)
,
(19)
где γ – коэффициент активности, a –
активность,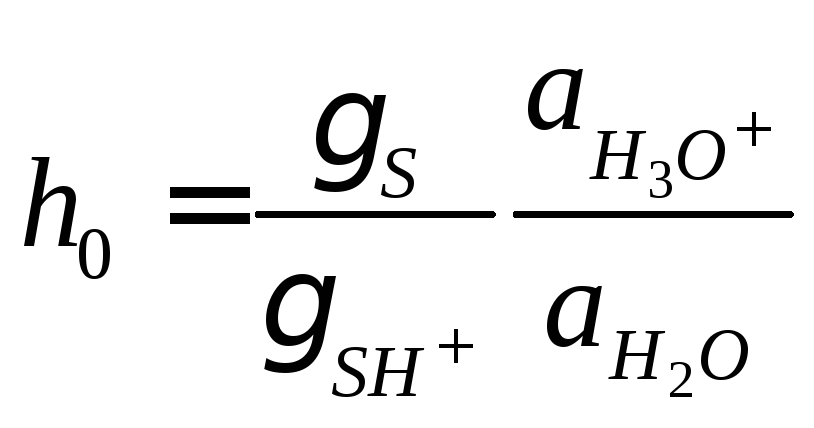 – кислотность среды, определяемая с
помощью индикатора с известным значениемKb. Чем больше значениеh0,
тем сильнее протонирован субстрат. В
разбавленном водном растворе все
коэффициенты активности и активность
воды равны 1, поэтому кислотность
совпадает с концентрацией ионов
гидроксония:h0= [H3O+].
– кислотность среды, определяемая с
помощью индикатора с известным значениемKb. Чем больше значениеh0,
тем сильнее протонирован субстрат. В
разбавленном водном растворе все
коэффициенты активности и активность
воды равны 1, поэтому кислотность
совпадает с концентрацией ионов
гидроксония:h0= [H3O+].
Логарифм кислотности, взятый с обратным знаком, называют функцией кислотности Гаммета:H0= –lgh0. Эту величину используют для характеристики кислотности среды в концентрированных водных растворах, где активности значительно отличаются от концентраций. В разбавленных водных растворах функция кислотности совпадает с водородным показателем:H0= pH.
Текущая концентрация субстрата связана с его начальной концентрацией уравнением материального баланса: [S]0= [S] + [SH+]. Учитывая это соотношение, а также уравнения (17) и (19), выражаем скорость каталитической реакции через начальную концентрацию субстрата:r =k[S]0,
где эффективная константа скорости k зависит от кислотности средыh0:
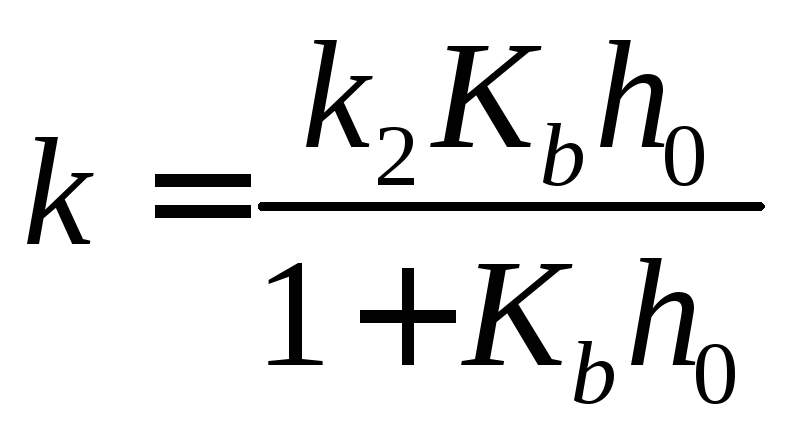 .
(20)
.
(20)
Измеряя константу скорости в растворах с разной кислотностью, можно определить значения k2иKb.
Общий кислотный илиосновной катализ осуществляется кислотами (HA) или основаниями (B) Бренстеда:
общий кислотный катализ –
![]() ;
;
общий основной катализ –
![]() .
.
В этом случае каталитический эффект зависит от природы кислоты или основания, служащих катализаторами. Эта зависимость определяется, главным образом, силой кислоты или основания. Для реакций общего кислотного или основного катализа с одним и тем же субстратом известны корреляционные соотношения Бренстеда между константами скорости каталитических реакций и константами кислотности (Ka) или основности (Kb) катализатора:
![]() ,
,
![]() ,
,
где α и β – эмпирические параметры, не превышающие 1 и постоянные для данной реакции.
При кинетическом анализе общего кислотного катализа наряду с каталитическим действием кислоты HA необходимо учитывать влияние ионов H3O+и самой воды, поэтому кинетические уравнения имеют вид:
![]() (21)
(21)
При постоянных pH и концентрации катализатора это уравнение описывает реакцию первого порядка. Аналогичное уравнение для общего основного катализа выглядит следующим образом:
![]() (22)
(22)
Из соотношений для специфического кислотного катализа следует, что константа скорости зависит от коэффициентов активности, которые, в свою очередь, определяются ионной силой раствора. Поэтому изменение ионной силы раствора может повлиять на скорость каталитической реакции. Это влияние называют первичным солевым эффектом. Из соотношений (21, 22) для общего кислотно-основного катализа видно, что скорость реакции зависит от концентрации кислоты или основания. Добавление к раствору одноименных ионов A–или BH+приведет к смещению кислотно-основного равновесия и увеличению этих концентраций, поскольку
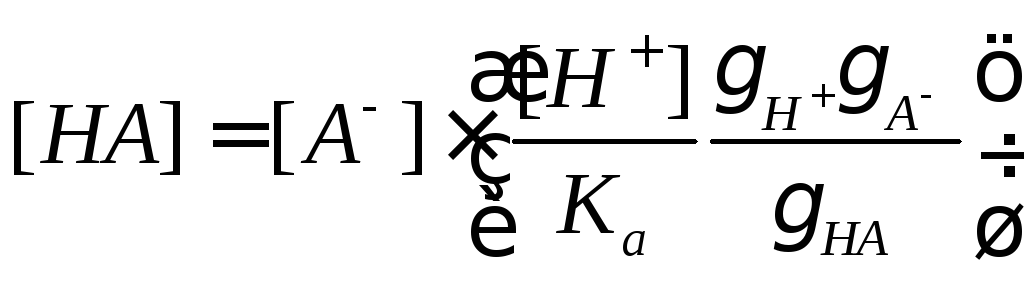 ,
(23)
,
(23)
что повлияет на константу скорости. Это явление называют вторичным солевым эффектом.
Лабораторная работа 1
