
- •Термодинамика растворения
- •Идеальные и неидеальные растворы
- •Коллигативные свойства разбавленных растворов неэлектролитов Осмос и осмотическое давление
- •Биологическая роль осмоса
- •Распределение воды между клетками и внеклеточной жидкостью
- •Распределение жидкости между сосудистым руслом и межклеточным пространством
- •Давление пара растворителя над раствором.
- •I закон Рауля
- •I закон Рауля ф.М. (1886 г.)
- •Понижение температуры замерзания и повышение температуры кипения растворов
- •II закон Рауля или следствия из I закона Рауля:
- •Криоскопические и эбулиоскопические константы некоторых растворителей
- •Эбулиоскопия и криоскопия
- •Коллигативные свойства разбавленных растворов электролитов
- •Основные вопросы темы:
- •Экспериментальные работы
- •Ход работы
- •Приготовление охлаждающей смеси.
- •Определение температуры замерзания растворителя.
- •4. Расчеты
- •Ход работы
- •Тестовый самоконтроль
- •Укажите правильные утверждения:
- •Эталоны решения задач
- •Вариант решения 1:
- •Вариант решения 2:
- •Глава IV
- •Учение о растворах. Теории растворов слабых и сильных электролитов. Протонная теория кислот и оснований.
- •Ионное произведение воды и водородный показатель.
- •Биомедицинская значимость темы
- •Теория растворов слабых электролитов
- •Основные положения.
- •Теория растворов сильных электролитов
- •Основные положения.
- •Протонная (протолитическая) теория кислот и оснований
- •Основные положения.
- •Классификация кислот.
- •Классификация оснований
- •Классификация растворителей.
- •Типы протолитических реакций
- •Ионное произведение воды и водородный показатель
- •Водородный показатель.
- •Расчет рН растворов сильных и слабых электролитов
- •Роль ионов водорода в биологических процессах
- •Определение водородного показателя
- •Кислотно-основные индикаторы
- •Основные вопросы темы
- •Экспериментальные работы
- •Ход выполнения работы
- •Тестовый cамоконтроль
- •Как изменится константа диссоциации уксусной кислоты при разбавлении раствора в 4 раза:
- •Эталоны решения задач
- •Решение:
- •Решение:
- •Глава V Учение о растворах. Буферные растворы. Биомедицинская значимость темы
- •Классификация буферных систем
- •Расчет рН буферных систем
- •Механизм действия буферных систем:
- •Буферная емкость
- •Буферные системы организма
- •Основные вопросы темы
- •Экспериментальные работы
- •Ход выполнения работы
- •Ход выполнения работы
- •Тестовый самоконтроль
- •Эталоны решения задач
- •Решение:
- •Решение:
- •Решение:
Давление пара растворителя над раствором.
I закон Рауля
Испарение – переход части молекул жидкости (воды) из жидкого агрегатного состояния в пар. При испарении необходимо преодолеть силы межмолекулярного сцепления жидкости и силы внешнего давления воздуха на поверхность жидкости. Эта работа, совершается за счет кинетической энергии теплового движения молекул, и, поэтому, испарение является эндотермическим процессом. С повышением температуры скорость испарения увеличивается. Процесс испарения является обратимым. Конденсация, то есть переход молекул из газовой фазы в жидкую, это процесс обратный испарению. Конденсация – процесс экзотермический.
В закрытом сосуде с жидкостью с течением времени при определенной температуре устанавливается равновесие (Vиспарения = V конденсации). Пар над жидкостью в состоянии равновесия считают насыщенным при данной температуре. Этот пар производит определенное давление на поверхность жидкой фазы. Это давление насыщенного пара растворителя.
Допустим, в систему жидкость – пар, достигшую равновесия, внесено нелетучее вещество. Его переход в паровую фазу исключен. При образовании раствора концентрация растворителя уменьшается, то есть его мольная доля становится меньше единицы (χр-ля < 1). По принципу Ле-Шателье процесс конденсации усиливается. Это приводит к снижению давления насыщенного пара. Таким образом, давление насыщенного пара над раствором меньше, чем над чистым растворителем.
I закон Рауля ф.М. (1886 г.)
Первая формулировка I закона Рауля:
“Понижение давления насыщенного пара растворителя над раствором равно давлению насыщенного пара над чистым растворителем, умноженному на мольную долю растворенного вещества”.
Р
= Ро
χв
или Ро
– Р = Ро
![]() (2)
(2)
где Ро - давление насыщенного пара над чистым растворителем; Р – давление насыщенного пара растворителя над раствором; χв – мольная доля растворенного вещества; nв – количество растворенного вещества; nр-ля – количество растворителя.
Вторая формулировка I закона Рауля:
“Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества”.
![]() =
χв
(3)
=
χв
(3)
Третья формулировка I закона Рауля:
“Давление насыщенного пара растворителя над раствором равно давлению насыщенного пара над чистым растворителем, умноженному на мольную долю растворителя”
Р
= Ро
χр-ля,
где χр-ля
=
![]() (4)
(4)
Понижение температуры замерзания и повышение температуры кипения растворов
С давлением насыщенного пара тесно связаны такие свойства растворов, как температура кипения и температура замерзания.
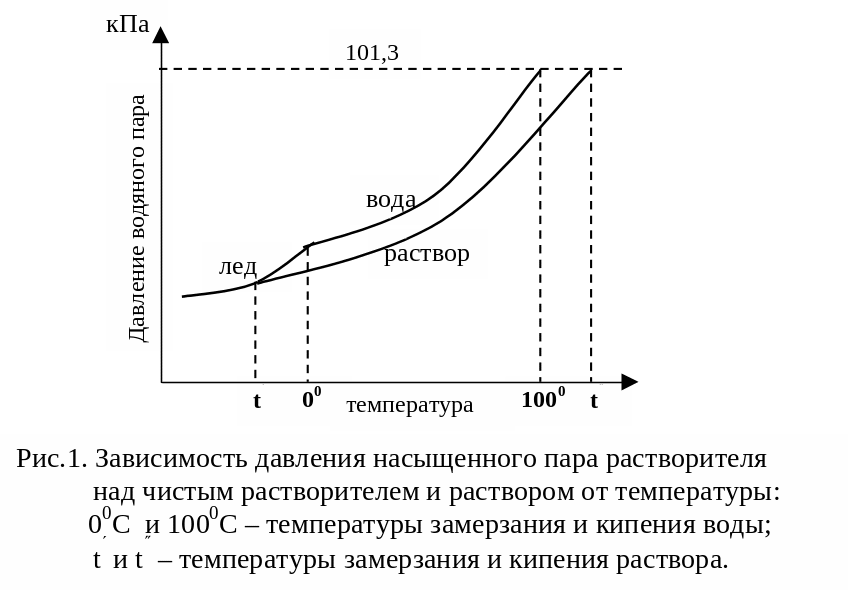
Жидкость закипает тогда, когда давление насыщенного пара над ней равно внешнему (атмосферному) давлению.
Жидкость замерзает тогда, когда давление ее насыщенного пара над жидкостью будет равно давлению насыщенного пара над твердой фазой (льдом).
Так как давление насыщенного пара над раствором меньше, чем над чистым растворителем (водой), то для закипания раствора требуется более высокая, а для замерзания – более низкая температура, чем для растворителя (воды) (рис.1).
II закон Рауля или следствия из I закона Рауля:
“Повышение температуры кипения tкип или понижение температуры замерзания (кристаллизации) tзам растворов по сравнению с чистым растворителем прямо пропорционально моляльности раствора”
tкип = E Cm; (5)
tзам = К Cm; (6)
Cm=
![]() ,
nв=
,
nв=
![]() (7)
(7)
где Е– эбулиоскопическая (эбулиометрическая) константа, кгградмоль-1, К – криоскопическая (криометрическая) константа, кгградмоль-1, Сm – моляльность, моль/кг.
Е и К зависят только от природы растворителя, но не от природы растворенного вещества. Значение этих констант для некоторых растворителей приведены в таблице 2.
Таблица 2
