
- •Термодинамика растворения
- •Идеальные и неидеальные растворы
- •Коллигативные свойства разбавленных растворов неэлектролитов Осмос и осмотическое давление
- •Биологическая роль осмоса
- •Распределение воды между клетками и внеклеточной жидкостью
- •Распределение жидкости между сосудистым руслом и межклеточным пространством
- •Давление пара растворителя над раствором.
- •I закон Рауля
- •I закон Рауля ф.М. (1886 г.)
- •Понижение температуры замерзания и повышение температуры кипения растворов
- •II закон Рауля или следствия из I закона Рауля:
- •Криоскопические и эбулиоскопические константы некоторых растворителей
- •Эбулиоскопия и криоскопия
- •Коллигативные свойства разбавленных растворов электролитов
- •Основные вопросы темы:
- •Экспериментальные работы
- •Ход работы
- •Приготовление охлаждающей смеси.
- •Определение температуры замерзания растворителя.
- •4. Расчеты
- •Ход работы
- •Тестовый самоконтроль
- •Укажите правильные утверждения:
- •Эталоны решения задач
- •Вариант решения 1:
- •Вариант решения 2:
- •Глава IV
- •Учение о растворах. Теории растворов слабых и сильных электролитов. Протонная теория кислот и оснований.
- •Ионное произведение воды и водородный показатель.
- •Биомедицинская значимость темы
- •Теория растворов слабых электролитов
- •Основные положения.
- •Теория растворов сильных электролитов
- •Основные положения.
- •Протонная (протолитическая) теория кислот и оснований
- •Основные положения.
- •Классификация кислот.
- •Классификация оснований
- •Классификация растворителей.
- •Типы протолитических реакций
- •Ионное произведение воды и водородный показатель
- •Водородный показатель.
- •Расчет рН растворов сильных и слабых электролитов
- •Роль ионов водорода в биологических процессах
- •Определение водородного показателя
- •Кислотно-основные индикаторы
- •Основные вопросы темы
- •Экспериментальные работы
- •Ход выполнения работы
- •Тестовый cамоконтроль
- •Как изменится константа диссоциации уксусной кислоты при разбавлении раствора в 4 раза:
- •Эталоны решения задач
- •Решение:
- •Решение:
- •Глава V Учение о растворах. Буферные растворы. Биомедицинская значимость темы
- •Классификация буферных систем
- •Расчет рН буферных систем
- •Механизм действия буферных систем:
- •Буферная емкость
- •Буферные системы организма
- •Основные вопросы темы
- •Экспериментальные работы
- •Ход выполнения работы
- •Ход выполнения работы
- •Тестовый самоконтроль
- •Эталоны решения задач
- •Решение:
- •Решение:
- •Решение:
Типы протолитических реакций
Протолитические реакции сопровождаются переносом протона.
1. Реакция ионизации
HCl + H2O ⇄ H3O+ + Cl–
кислота 1 основание 2 кислота 2 основание 1
2.Реакция нейтрализации.
![]() +
ОН–
⇄
+
ОН–
⇄
![]() + Н2О
+ Н2О
кислота1 основание 2 основание1 кислота 2
3. Реакция гидролиза
СН3СОО– + Н2О ⇄ СН3СООН + ОН–
основание1 кислота2 кислота 1 основание2
Ионное произведение воды и водородный показатель
Вода — очень слабый электролит и диссоциирует незначительно. Диссоциация Н2О – это протолитическая реакция:
Н2О + Н2О ⇄ Н3О+ + ОН–
основание 1 кислота 2 кислота1 основание 2
или упрощенно: Н2О ⇄ Н+ + ОН–
Константа диссоциации воды при 298К, определенная методом электрической проводимости, равна:
Кд(Н2О)
=
![]() = 1,8
10 16моль/л
= 1,8
10 16моль/л
Вода присутствует в большом избытке, ее концентрация [Н2О] может считаться постоянной и составляет 55,6 моль/л (1000 г : 18 г/моль = 55,6 моль). Объединяем две постоянные величины Кд(Н2О) и [H2O] в одну, получаем:
![]() =[H+][OH–]
= 1,8
1016
55,6 = 10
14
=[H+][OH–]
= 1,8
1016
55,6 = 10
14
Величину
![]() называют ионным произведением воды.
Эта величина постоянная при данной
температуре. С ростом температуры
ионное произведение воды увеличивается.
называют ионным произведением воды.
Эта величина постоянная при данной
температуре. С ростом температуры
ионное произведение воды увеличивается.
Если [H+] = [OH ] = 10–7 моль/л, то это нейтральная среда. Если [H+] [OH], т.е. [H+] 107, то раствор имеет кислую среду. Если [H+][OH ], т.е. [H+] 10 7, то раствор имеет щелочную среду.
Водородный показатель.
На практике использование концентрации водородных ионов [H+] для характеристики cреды не очень удобно. Поэтому для этой цели используют отрицательный десятичный логарифм активности (концентрации) водородных ионов, называемый водородным показателем рН среды:
рН = – lg a(H+) или рН = –lg[H+]
Аналогично гидроксильный показатель рОН = – lg a(OH ) или рОН = – lg[OH ]
Например, если [H+] = 10 2 моль/л (кислая среда), то рН = 2, а когда [H+] =109 моль/л (щелочная среда), то рН = 9. В нейтральной среде [H+] = 107 моль/л и рН = 7. Из этих примеров следует, что:
если рН = 7, то это нейтральная среда;
если рН < 7, то это кислая среда;
если рН > 7, то это щелочная среда.
Логарифмируя выражение [H+][OH-] = 10–14 и проведя математические преобразования, получаем: рН + рОН = 14.
Шкала [Н+] и рН
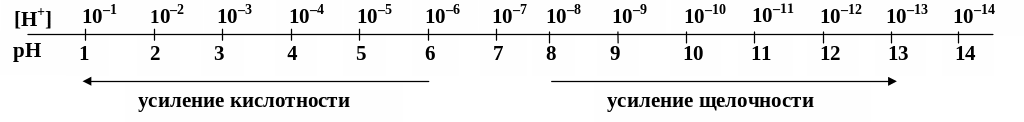
Расчет рН растворов сильных и слабых электролитов
1. Для растворов сильных кислот и оснований:
а)
H2SO4
2H+
+
![]() ,
[H+]
= CH
(к-ты)fa,
,
[H+]
= CH
(к-ты)fa,
где СН – молярная концентрация эквивалента, fa – коэффициент активности;
для разбавленных растворов fa 1.
рН = – lg[H+] = – lg CH (к-ты) fa.
б) Ва(ОН)2 Ва2+ + 2ОН–, [ОН–] = CH (осн.) fa
рОН = – lg[ОН–] = – lg CH (осн.) fa
рН = 14 – рОН
2. Для растворов слабых кислот и оснований:
а) СН3СООН ⇄СН3СОО– + Н+, [H+] = CH (к-ты),
где CH (к-ты) – количество продиссоциированных молекул слабой
кислоты
рН = – lg[H+] = – lgCH (к-ты).
б)
NH4OH
⇄![]() + OH–,
[OH–]
= CH
(осн.),
+ OH–,
[OH–]
= CH
(осн.),
где CH (осн.) – количество продиссоциированных молекул слабого
основания
рОН = – lg[ОН–] = – lg CH (осн.)
рН = 14 – рОН.
