
- •Удельная электрическая проводимость
- •Удельная электрическая проводимость может быть вычислена теоретически:
- •Молярная электрическая проводимость.
- •Электрическая проводимость биологических объектов и ее использование в медико-биологических исследованиях
- •Измерение электрической проводимости
- •Применение метода электропроводности для аналитических и физико-химических измерений (кондуктометрия).
- •Кондуктометрическое определение степени и константы диссоциации слабого электролита
- •Кондуктометрическое титрование
- •Основные вопросы темы
- •Удельная электрическая проводимость 0,001м kCl в зависимости от температуры
- •Подвижность ионов в зависимости от температуры
- •Тестовый самоконтроль
- •В каком ряду биологических жидкостей удельная электрическая проводимость уменьшается:
- •Эталоны решения задач
- •Решение
Все ткани организма пропитаны и омываются биологическими жидкостями, в которых растворены сильные и слабые электролиты. Поэтому такие биологические жидкости как кровь, лимфа, спинномозговая жидкость, слезная жидкость, слюна и т.д. относятся к проводникам второго рода.
Абсолютная скорость движения ионов. В растворах электролитов сольватированные ионы находятся в беспорядочном движении. При наложении электрического поля возникает упорядоченное движение ионов к противоположно заряженным электродам.
Сравнение скоростей движения различных видов ионов производят при градиенте потенциала поля 1 В/м. Для этих условий скорость движения ионов называют абсолютной, обозначают буквой и выражают в м2B–1c–1. Абсолютная скорость движения иона –– это расстояние в метрах, которое проходит ион за 1 с при градиенте потенциала 1В/м. Численные значения абсолютных скоростей движения ионов в данном растворителе зависят только от их природы и температуры.
Для оценки способности ионов к перемещению под действием внешнего поля пользуются также количественной характеристикой – подвижность ионов (U). Подвижность иона представляет собой произведение числа Фарадея (F = 96465 BсСммоль–1) на абсолютную скорость движения иона и выражается в См м2моль–1:
U = F (1)
Значения абсолютных скоростей движения и подвижностей ионов при 250С представлены в таблице 1:
Таблица 1
Катион |
м2B–1c–1 |
U См м2моль–1 |
Анион |
м2B–1c–1 |
U См м2моль–1 |
H+ |
36,310–8 |
349,910–4 |
OH– |
20,610–8 |
199,210–4 |
Li+ |
4,010–8 |
38,710–4 |
F– |
5,710–8 |
55,410–4 |
Na+ |
5,210–8 |
50,310–4 |
Cl– |
7,910–8 |
76,310–4 |
K+ |
7,610–8 |
73,510–4 |
Br– |
8,110–8 |
78,410–4 |
Rb |
8,010–8 |
77,510–4 |
I– |
8,010–8 |
76,910–4 |
Cs+ |
8,010–8 |
77,510–4 |
|
7,410–8 |
71,510–4 |
|
7,610–8 |
73,510–4 |
CH3COO– |
4,210–8 |
40,910–4 |
Mg2+ |
5,510–8 |
106,110–4 |
|
7,210–8 |
138,610–4 |
Al3+ |
6,510–8 |
183,210–4 |
|
8,310–8 |
159,610–4 |
Из приведенных в табл.1 данных можно усмотреть некоторые закономерности. Во-первых, абсолютная скорость движения катионов растет в пределах одной группы периодической системы элементов с ростом порядкового номера, как это видно из данных для катионов щелочных металлов. Сравнение расположенных в одном периоде и имеющих приблизительно одинаковый размер ионов Na+, Mg2+, Al3+ показывает незначительное увеличение абсолютной скорости движения с увеличением заряда иона. Оба эти факта объясняются явлением сольватации ионов в растворе. Молекулы растворителя группируются вокруг иона и увеличивают его эффективный радиус (который называется гидродинамическим радиусом).
В электрическом поле в растворах электролитов перемещается не свободный ион, а ион с плотно связанной с ним сольватной оболочкой. В силу меньшего размера ион Li+ сильнее притягивает диполи воды и в итоге имеет большую сольватную оболочку, чем ион калия. Следовательно, небольшие ионы имеют больший гидродинамический радиус и характеризуются меньшей абсолютной скоростью движения. Этим же объясняется малое отличие в абсолютной скорости движения ионов Na+, Mg2+, Al3+. С увеличением заряда, естественно, резко возрастает сольватная оболочка и тем самым размер перемещающейся частицы. Это увеличение размера почти полностью компенсирует эффект увеличения заряда.
Обращает также на себя внимание аномально высокая абсолютная скорость движения ионов гидроксония H3O+(H+) и гидроксила OH–. Можно предположить, что ион Н+ должен быть сильно сольватирован, тем не менее он способен быстро передвигаться в растворе. В этом случае нельзя применить гидродинамический довод, поскольку действует так называемый «эстафетный механизм» перемещения ионов гидроксония и гироксила. В цепочке, построенной из молекул воды, заряд может перейти от одного конца цепочки к другому в результате сравнительно небольшого перемещения протонов, образующих водородные связи между молекулами воды, например:
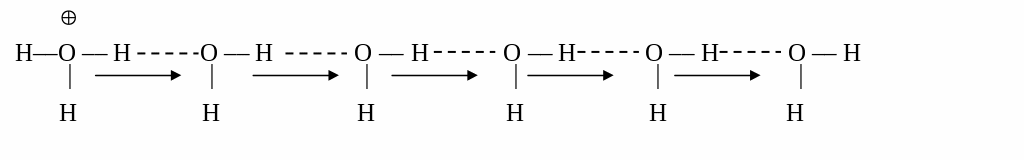 Из
приведенной схемы видно, что перемещение
электрического заряда происходит без
перемещения атомов водорода. Иными
словами, вместо одного иона Н+,
двигающегося в растворе, существует
эффективное движение иона Н+
, включающее образование и разрыв связей
вдоль длинной цепочки молекул воды.
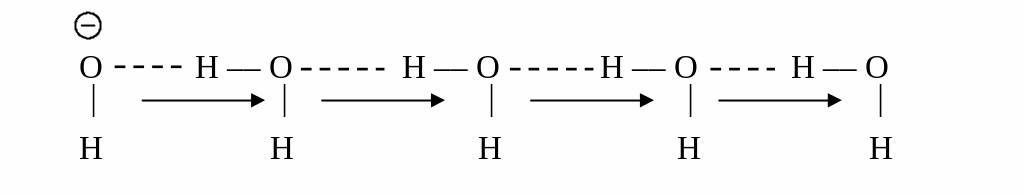
Аналогичную схему легко изобразить и
для перемещения гидроксид-иона.
Из
приведенной схемы видно, что перемещение
электрического заряда происходит без
перемещения атомов водорода. Иными
словами, вместо одного иона Н+,
двигающегося в растворе, существует
эффективное движение иона Н+
, включающее образование и разрыв связей
вдоль длинной цепочки молекул воды.
Аналогичную схему легко изобразить и
для перемещения гидроксид-иона.
Повышение температуры влияет на абсолютную скорость движения ионов путем дегидратации и уменьшения вязкости среды, что способствует увеличению скорости перемещения ионов.
Удельная электрическая проводимость
Электрическая проводимость (L) –– это способность веществ проводить электрический ток под действием электрического поля. Она представляет собой величину обратную электрическому сопротивлению R:
L
=
![]() (2)
(2)
Единицей электрической проводимости в CИ является сименс (См), и 1 См = 1 Ом–1.
Известно,
что R = ![]() ,
поэтому L =
=
,
поэтому L =
=![]() , так как
, так как
![]() =
æ,
то:
=
æ,
то:
L
== æ ![]() ,
(3)
,
(3)
г

Удельной электрической проводимостью называется электрическая проводимость 1м3 раствора, находящегося в однородном электрическом поле при напряженности 1 В/м. Единицей удельной проводимости в CИ служит сименс/метр (См/м). Удельная электрическая проводимость зависит от многих факторов и, прежде всего, от природы электролита, его концентрации и температуры. Изотермы удельной электрической проводимости (рис.1) дают представление о характере зависимости удельной электрической проводимости от природы электролита и его концентрации для 250С (298К). Анализ изотермы позволяет сделать следующие выводы:
1. Удельная электрическая проводимость максимальна для растворов сильных кислот и несколько меньше – сильных оснований, что объясняется полной диссоциацией этих электролитов и высокой подвижностью ионов Н3О+ и ОН–.
2. Наименьшие значения во всем диапазоне концентраций имеет удельная электрическая проводимость растворов слабых электролитов (СН3СООН) в связи с низкой концентрацией ионов (<<1).
3. Удельная электрическая проводимость растет с увеличением концентрацией до некоторых максимальных значений, что отвечает увеличению количества ионов в единице объема раствора. Достигнув максимума, удельная электрическая проводимость начинает уменьшаться, несмотря на рост концентрации электролита. Подобный характер зависимости æ от С связан у сильных электролитов с уменьшением подвижности ионов из-за возрастающего по мере увеличения концентрации раствора межионного взаимодействия, а у слабых электролитов – с уменьшением степени электролитической диссоциации электролита, а значит, и уменьшением количества ионов в единице объема раствора.
С увеличением температуры удельная электрическая проводимость растет. Это обусловлено, в основном, дегидратацией ионов и уменьшением вязкости среды, т.е. уменьшением сопротивления движению ионов.
Удельная электрическая проводимость растворов зависит от разведения. Разведение величина обратная концентрации. (Разведение обозначается символом V или 1/С и характеризует объем раствора, содержащий 1 моль электролита). Когда разведение мало – раствор концентрирован и степень диссоциации слабого электролита мала. С ростом разведения сначала увеличивается, а, следовательно, и увеличивается удельная электрическая проводимость. При дальнейшем увеличении разведения степень диссоциации приближается к единице и перестает расти, в то время как общее количество электролита в единице объема уменьшается, что вызовет падение электрической проводимости.
