
- •Удельная электрическая проводимость
- •Удельная электрическая проводимость может быть вычислена теоретически:
- •Молярная электрическая проводимость.
- •Электрическая проводимость биологических объектов и ее использование в медико-биологических исследованиях
- •Измерение электрической проводимости
- •Применение метода электропроводности для аналитических и физико-химических измерений (кондуктометрия).
- •Кондуктометрическое определение степени и константы диссоциации слабого электролита
- •Кондуктометрическое титрование
- •Основные вопросы темы
- •Удельная электрическая проводимость 0,001м kCl в зависимости от температуры
- •Подвижность ионов в зависимости от температуры
- •Тестовый самоконтроль
- •В каком ряду биологических жидкостей удельная электрическая проводимость уменьшается:
- •Эталоны решения задач
- •Решение
Применение метода электропроводности для аналитических и физико-химических измерений (кондуктометрия).
Кондуктометрия – это совокупность физико-химических методов, основанных на измерении сопротивления изучаемых объектов, представляющих собой проводники второго рода. По значению сопротивления раствора электрическому току, протекающему между двумя электродами, погруженными в раствор, определяют электрическую проводимость. При помощи кондуктометрии можно определить концентрацию растворенного вещества, константу и степень диссоциации слабого электролита, растворимость и произведение растворимости труднорастворимых веществ, ионное произведение воды и другие физико-химические величины.
Кондуктометрическое определение степени и константы диссоциации слабого электролита
Зависимость между молярной электрической проводимостью λm и концентрацией слабого электролита может быть установлена с помощью закона разбавления Оствальда. Например, для равновалентных электролитов:
Kд
=
![]()
где Kд – константа равновесия диссоциации слабого электролита, – степень диссоциации, С – молярная концентрация электролита. Подставляя в это уравнение соотношение Аррениуса = λ m / λ , получим:
Kд
=
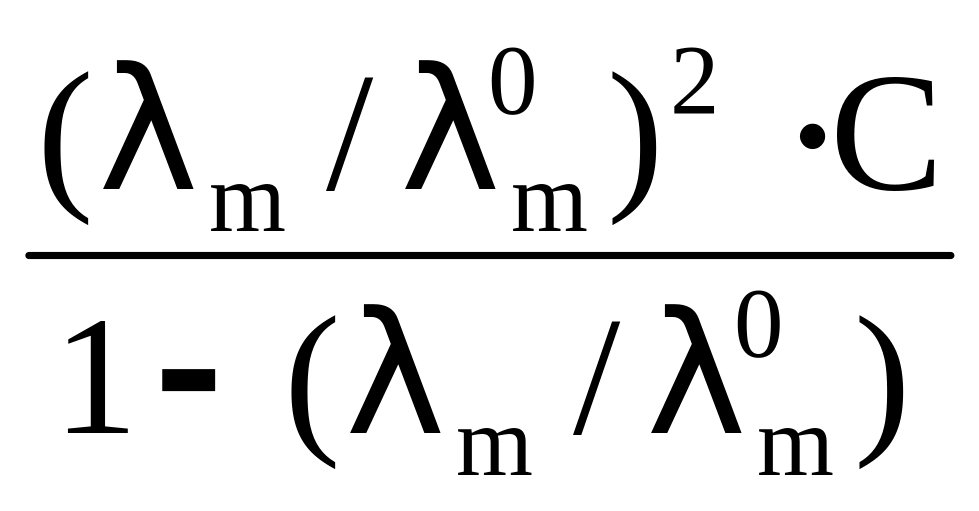
Это выражение может быть использовано для определения константы диссоциации слабого электролита, если измерить электрическую проводимость раствора заданной концентрации. Значение λ можно получить из закона Кольрауша.
Кондуктометрическое титрование
Измерение электрической проводимости растворов широко применяют в титриметрическом анализе для определения точки эквивалентности (кондуктометрическое титрование). Метод кондуктометрического титрования основан на том, что в растворе, благодаря идущей в нем химической реакции, ионы, движущиеся с одной скоростью заменяются ионами, движущимися с другой скоростью. В методах кондуктометрического титрования измеряют электрическую проводимость раствора после добавления небольших определенных порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах æ – V титранта. Практически в этом методе могут быть использованы такие химические реакции, в ходе которых достаточно заметно изменяется электрическая проводимость раствора или происходит резкое изменение электрической проводимости после точки эквивалентности (реакции кислотно-основного взаимодействия, осаждения и т.д.).
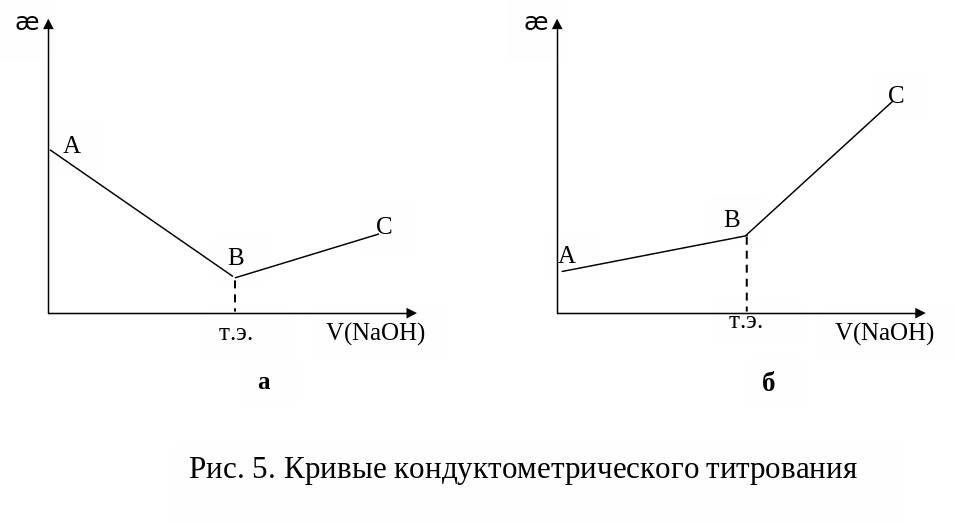
На рис.5 приведены кривые зависимости удельного электрической проводимости æ от объема приливаемого титранта. При титровании сильной кислоты сильным основанием (рис.5а) на кривой титрования образуется минимум (точка эквивалентности), соответствующий замене ионов водорода на менее подвижные ионы образующейся соли (ветвь АВ):
H+ + Cl– + Na+ + OH– = H2O + Na+ + Cl–
После точки эквивалентности начинается резкий подъем электрической проводимости (ветвь ВС) т.к. в растворе будет нарастать концентрация ионов Na+ и ОН–. Однако возрастание по ветви ВС будет более пологим, чем уменьшение по ветви АВ, так как подвижность иона ОН– почти в 2 раза меньше подвижности иона водорода.
При титровании слабой кислоты сильным основанием (рис.5б) увеличивается электрическая проводимость раствора, что объясняется значительной диссоциацией образующейся соли по сравнению с диссоциацией исходного вещества (ветвь АВ):
CH3COOH + Na+ + OH– = H2O + CH3COO– + Na+
После точки эквивалентности начинается резкий подъем электрической проводимости (ветвь ВС) т.к. в растворе будет нарастать концентрация ионов Na+ и ОН–.
Кондуктометрическое титрование используют для определения концентрации окрашенных, мутных растворов, в которых изменение цвета индикатора маскируется, в том числе и в биологических жидкостях.
