
- •Удельная электрическая проводимость
- •Удельная электрическая проводимость может быть вычислена теоретически:
- •Молярная электрическая проводимость.
- •Электрическая проводимость биологических объектов и ее использование в медико-биологических исследованиях
- •Измерение электрической проводимости
- •Применение метода электропроводности для аналитических и физико-химических измерений (кондуктометрия).
- •Кондуктометрическое определение степени и константы диссоциации слабого электролита
- •Кондуктометрическое титрование
- •Основные вопросы темы
- •Удельная электрическая проводимость 0,001м kCl в зависимости от температуры
- •Подвижность ионов в зависимости от температуры
- •Тестовый самоконтроль
- •В каком ряду биологических жидкостей удельная электрическая проводимость уменьшается:
- •Эталоны решения задач
- •Решение
Удельная электрическая проводимость может быть вычислена теоретически:
æ=FC(А + K) – для слабых электролитов (4)
æ=FCfa(А + K) –для сильных электролитов (5)
где F – число Фарадея, С – концентрация электролита (моль/м3), – степень диссоциации слабого электролита, fa – коэффициент активности сильного электролита, А и K – абсолютная скорость движения аниона и катиона в м/сек при градиенте потенциала 1 В/м.
Молярная электрическая проводимость.
Молярная электрическая проводимость – электрическая проводимость 1 моль электролита, находящегося в растворе между параллельными электродами с расстоянием между ними 1 м и градиенте потенциала 1В/м. Между удельной электрической проводимостью и молярной электрической проводимостью (λm) существует зависимость:
λm = æ/C, (6)
где λm (лямда) – молярная электрическая проводимость, Смм2моль–1, æ – удельная электрическая проводимость, Смм–1; С – концентрация электролита в растворе, моль/м3.
Обычно молярная концентрация характеризуется количеством вещества в 1 дм3 (1л), а не в 1м3. В этом случае соотношение имеет вид:
λ m= æ/1000C (7)
Молярную электрическую проводимость, как и удельную, можно рассчитать теоретически:
λm
=![]() =
F(А
+ K)
– для слабых электролитов (8)
=
F(А
+ K)
– для слабых электролитов (8)
λm
=![]() =
Ffa(А
+ K)
–для сильных электролитов (9)
=
Ffa(А
+ K)
–для сильных электролитов (9)
Значение
молярной электрической проводимости
при разбавлении раствора (при С
0) увеличивается, стремясь к постоянной
и специфической для каждого электролита
величине, называемой предельной молярной
электрической проводимостью и обозначаемой
λ![]() (рис.2).
(рис.2).
Предельной молярной электрической проводимостью электролита называется значение молярной электрической проводимости при бесконечном разбавлении.
Увеличение значений λm связано у слабых электролитов с ростом степени диссоциации при разбавлении раствора (1 при С 0), т.е. связано с увеличением количества ионов, образуемых 1 моль электролита при данной температуре.
У сильных электролитов при бесконечном разбавлении уменьшается межионное взаимодействие, абсолютная скорость движения ионов достигает предельных значений, поэтому молярная электрическая проводимость перестает зависеть от концентрации и становится постоянной величиной.
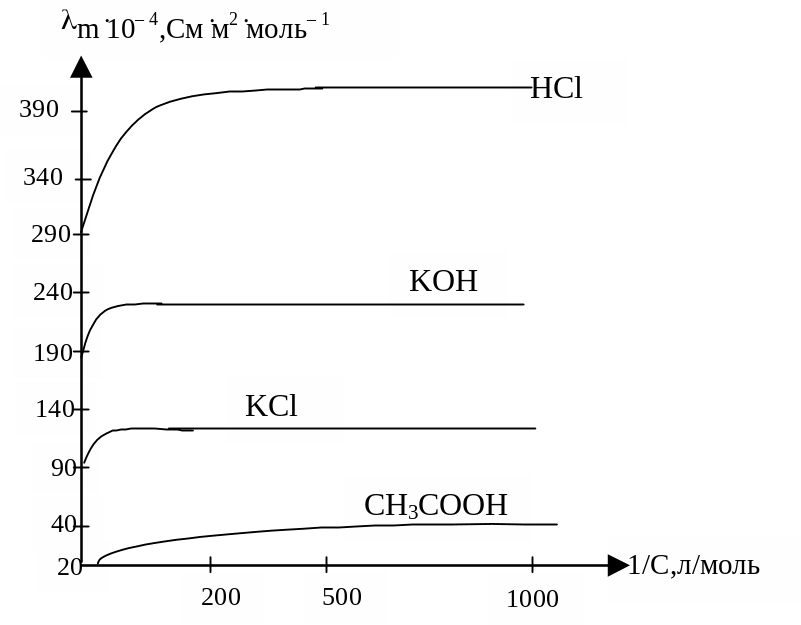
Рис.2. Зависимость молярной элекрической проводимости от
концентрации раствора для некоторых электролитов
Молярная электрическая проводимость при данном разбавлении λm всегда меньше значения предельной молярной электрической проводимости λ . Отношение этих величин, т.е. λm/λ характеризует:
а)
для слабого
электролита – степень его диссоциации
при данной концентрации раствора, т.е.
![]() =
(соотношение Аррениуса)
=
(соотношение Аррениуса)
б) для сильного электролита – коэффициент активности (fa) при данной концентрации, т.е. = fa
Полагая, что при бесконечном разбавлении растворов слабых электролитов
1, а растворов сильных электролитов fa 1, уравнения (8), (9) примут следующий вид:
λ = F (А + K) (10)
Следовательно, при бесконечном разбавлении растворов электролитов их молярная электрическая проводимость зависит только от абсолютных скоростей движения ионов к электродам. Так как U = F , то:
λ = UK + UA (11)
Из последнего уравнения следует, что сумма подвижностей катиона и аниона равна молярной электрической проводимости при бесконечном разведении.
Часто
подвижность катиона UK
обозначают λ![]() и называют предельной проводимостью
катиона, а подвижность аниона UA
обозначают λ
и называют предельной проводимостью
катиона, а подвижность аниона UA
обозначают λ![]() и называют предельной подвижностью
аниона. Тогда уравнение λ
=
UK
+ UA будет
иметь следующий вид:
и называют предельной подвижностью
аниона. Тогда уравнение λ
=
UK
+ UA будет
иметь следующий вид:
λ = λ + λ (12)
Отсюда следует, что сумма предельных проводимостей катиона и аниона равна молярной электрической проводимости электролита при бесконечном разведении.
Уравнения (10), (11) и (12) выражают закон независимости движения ионов в бесконечно разбавленных растворах электролитов (закон Кольрауша).
Отсюда, например, предельная молярная электрическая проводимость уксусной кислоты будет равна:
λ
(CH3COOH)=
λ
(H+)+
λ![]() (CH3COO–).
(CH3COO–).
