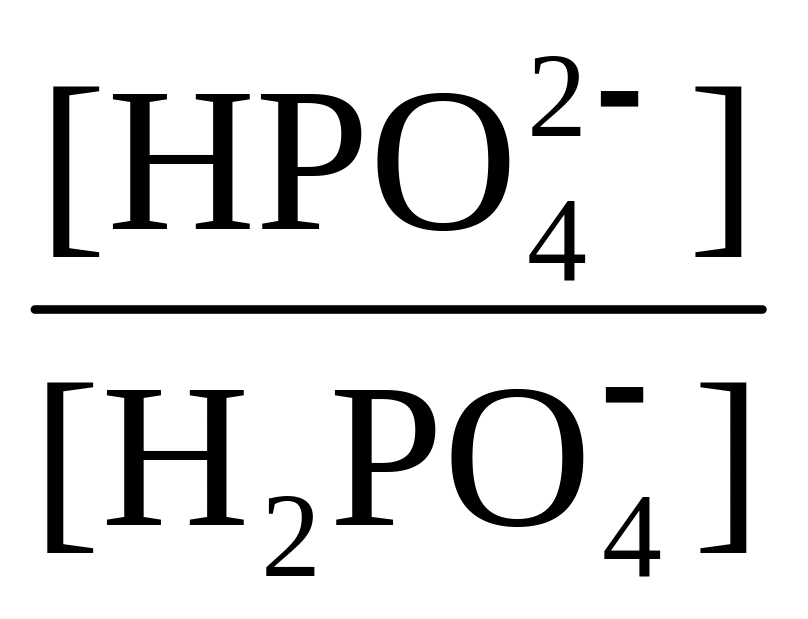- •Термодинамика растворения
- •Идеальные и неидеальные растворы
- •Коллигативные свойства разбавленных растворов неэлектролитов Осмос и осмотическое давление
- •Биологическая роль осмоса
- •Распределение воды между клетками и внеклеточной жидкостью
- •Распределение жидкости между сосудистым руслом и межклеточным пространством
- •Давление пара растворителя над раствором.
- •I закон Рауля
- •I закон Рауля ф.М. (1886 г.)
- •Понижение температуры замерзания и повышение температуры кипения растворов
- •II закон Рауля или следствия из I закона Рауля:
- •Криоскопические и эбулиоскопические константы некоторых растворителей
- •Эбулиоскопия и криоскопия
- •Коллигативные свойства разбавленных растворов электролитов
- •Основные вопросы темы:
- •Экспериментальные работы
- •Ход работы
- •Приготовление охлаждающей смеси.
- •Определение температуры замерзания растворителя.
- •4. Расчеты
- •Ход работы
- •Тестовый самоконтроль
- •Укажите правильные утверждения:
- •Эталоны решения задач
- •Вариант решения 1:
- •Вариант решения 2:
- •Глава IV
- •Учение о растворах. Теории растворов слабых и сильных электролитов. Протонная теория кислот и оснований.
- •Ионное произведение воды и водородный показатель.
- •Биомедицинская значимость темы
- •Теория растворов слабых электролитов
- •Основные положения.
- •Теория растворов сильных электролитов
- •Основные положения.
- •Протонная (протолитическая) теория кислот и оснований
- •Основные положения.
- •Классификация кислот.
- •Классификация оснований
- •Классификация растворителей.
- •Типы протолитических реакций
- •Ионное произведение воды и водородный показатель
- •Водородный показатель.
- •Расчет рН растворов сильных и слабых электролитов
- •Роль ионов водорода в биологических процессах
- •Определение водородного показателя
- •Кислотно-основные индикаторы
- •Основные вопросы темы
- •Экспериментальные работы
- •Ход выполнения работы
- •Тестовый cамоконтроль
- •Как изменится константа диссоциации уксусной кислоты при разбавлении раствора в 4 раза:
- •Эталоны решения задач
- •Решение:
- •Решение:
- •Глава V Учение о растворах. Буферные растворы. Биомедицинская значимость темы
- •Классификация буферных систем
- •Расчет рН буферных систем
- •Механизм действия буферных систем:
- •Буферная емкость
- •Буферные системы организма
- •Основные вопросы темы
- •Экспериментальные работы
- •Ход выполнения работы
- •Ход выполнения работы
- •Тестовый самоконтроль
- •Эталоны решения задач
- •Решение:
- •Решение:
- •Решение:
Эталоны решения задач
Задача 1. К 2 л 0,1 М раствора CH3COOH прибавили 49,2 г CH3COONa . Вычислите рН полученного буферного раствора (Kд (CH3COOH) = 1,7510–5).
Решение:
Дано: V(раствора) = 2 л CМ(CH3COOH) = 0,1 моль/л m(CH3COONa) = 49,2 г Kд (CH3COOH) = 1,7510–5
|
CH3COOH ⇄ CH3COO– + H+ CH3COONa CH3COO– + Na+ 1. Вычисляем концентрацию ацетата натрия в растворе: CM(CH3COONa)=m(CH3COONa)/M(CH3COONa)V = 49,2 / 82 2 = 0,3 |
pH - ?
|
Вычисляем рН ацетатного буферного раствора:
pH
= –lgKд
+ lg
![]() = –lg1,75 10–5
+ lg
= –lg1,75 10–5
+ lg
![]() =
4,75
+ 0,48 = 5,23.
=
4,75
+ 0,48 = 5,23.
Ответ: pH = 5,23
Задача 2. Чему равен рН буферного раствора, содержащего в 1 л по 0,1 моль NH4OH и NH4Cl (рК (NH4OH) = 4,75)? Как изменится рН при разбавлении раствора водой в 10 раз?
Решение:
Дано: CM(NH4OH) = 0,1 моль/л CM(NH4Cl) = 0,1 моль/л V(раствора) = 1 л рК (NH4OH) = 4,75 |
1. Вычисляем рН1 исходного раствора: pH1
= 14–pK(NH4OH)–lg
|
рН1 - ? рН2 - ? |
Вычисляем рН2 раствора после разбавления. При разбавлении раствора в 10 раз концентрации соли и основания уменьшаются также в 10 раз:
рН2
= 14 – 4,75 – lg
![]() = 9,25*
= 9,25*
Ответ: pH1 = 9,25; pH2 9,25.
*Примечание: в действительности, величина рН при разбавлении несколько меняется (в нашем случае возрастает приблизительно на 0,07 единицы, что зависит от изменения коэффициентов активности ионов в связи с уменьшением ионной силы раствора при разбавлении).
Задача 3. Чтобы изменить рН на единицу, к 10 мл ацетатного буферного раствора потребовалось добавить 0,52 мл 1М раствора NaOH. Найти буферную емкость по щелочи (моль/лед.рН) данного буферного раствора.
Решение:
Дано: рН = 1 V(б.р.) = 10 мл = 0,01 л СМ(NaOH) = 1 моль/л V(щелочи) = 0,52 мл= 0,5210–3л |
Буферную емкость по щелочи можно определить по формуле: Восн.
=
= (Сн (NaOH) = СМ (NaOH)) |
Восн. - ? |
Ответ: 0,052 моль/лед. рН
|
Задачa 4. К 16 мл 0,1 М раствора Na2HPO4 прибавили 40 мл 0,04 М раствора NaH2PO4. Определить:
а) рН полученного буферного раствора (Кд (H2PO4-) = 1,6 10–7;
б) как изменится рН этого раствора при добавлении к нему 6 мл 0,1М раствора HCl;
в) можно ли приготовить фосфатный буферный раствор с рН=8,5.
Решение:
Дано: СМ (Na2HPO4) = 0,1 моль/л V(р-ра Na2HPO4) = 16 мл СМ (NaH2PO4) = 0,04 моль/л V(р-ра NaH2PO4) = 40 мл СМ (HCl) = 0,1 моль/л V (р-ра HCl) = 6 мл Кд ( ) = 1,6 10–7 |
а) Рассчитываем рН фосфатного буферного раствора В фосфатном буферном растворе роль кислоты выполняет ион , диссоциирующий по схеме: ⇄ H+ + . Так как константа диссоциации этого процесса мала, можно считать, что концентрация равна концентрации NaH2PO4, а концентрация равна концентрации Na2HPO4. Тогда :
|
а) pH – ? б) рН–? |
рН
= – lg Кд
( |
Необходимо учесть, что при смешивании двух растворов исходные концентрации компонентов изменяются. Новые концентрации можно рассчитать по формуле:
Cисх. Vисх. = Скон. Vкон. Тогда новая концентрация NaH2PO4 будет равна:
[NaH2PO4]
=
![]()
Конечная концентрация Na2HPO4 будет равна:
[Na2HPO4]
=
![]()
СМ (NaH2PO4)исх. V(р-ра NaH2PO4) = n (NaH2PO4) = 0,040 0,04 = 0,0016
СМ (Na2HPO4)исх. V(р-ра Na2HPO4) = n (Na2HPO4) = 0,016 0,1 =0,0016
Тогда
=
![]()
Отсюда:
pН = – lg 1,6
10–7
+ lg![]() = 6,8 + lg
= 6,8 + lg![]() =
6,8
+ lg1 = 6,8
=
6,8
+ lg1 = 6,8
б) Вычисляем изменение рН при добавлении к буферному раствору раствора HCl.
При добавлении 6 мл 0,1 М раствора HCl ( что составляет 0,0006 моль), добавленная кислота прореагирует с 0,0006 моль Na2HPO4 с образованием 0,0006 моль NaH2PO4:
Na2HPO4 + HCl = NaH2PO4 + NaCl
Тогда количество Na2HPO4 уменьшится на 0,0006 моль:
n (Na2HPO4) = 0,0016 – 0,0006 = 0,0010
А количество NaH2PO4 увеличится на 0,0006 моль:
n (NaH2PO4) = 0,0016 + 0,0006 =0,0022
Отсюда:
pН = – lg 1,6 10-7
+ lg
= 6,8 + lg
![]() = 6,46
= 6,46
рН = 6,8 – 6,46 = 0,34
в) Приготовить фосфатный буферный раствор с рН = 8,5 невозможно, так как зона эффективного действия буферной системы определяется соотношением рН = рК 1. Для фосфатного буферного раствора рК = 6,8, и зона эффективного буферного действия лежит в интервале рН 5,8 7,8.
Ответ : a) pH = 6,8; б) уменьшится на 0,34 ед. рН; в) невозможно.