
- •С.В. Іванов, п.С. Борсук, н.М. Манчук загальна хімічна технологія
- •Передмова
- •Теоретичні основи хімічної технології вступ
- •1. Основи хіміко-технологічних процесів
- •1.1 Хіміко-технологічний процес і його зміст
- •1.2. Класифікація хімічних реакцій, які покладені в основу промислових хіміко-технологічних процесів.
- •1.3. Технологічні критерії ефективності хіміко-технологічного процесу
- •2. Структура хімічного виробництва
- •3. Хіміко-технологічні системи
- •3.1. Поняття хіміко-технологічної системи (хтс)
- •3.2. Моделі хіміко-технологічних систем
- •3.3. Технологічні зв'язки в хтс
- •4. Поняття про синтез хіміко-
- •4.1. Texнологічні концепції створення хтс
- •4.2. Аналіз хтс
- •5. Матеріальні і теплові баланси хіміко-технологічних систем
- •5.1. Баланс співвідношень
- •5.1.2. Приклади розрахунку балансів
- •5.2 Основні поняття ексергетичного аналізу хтс
- •6. Термодинамічні розрахунки хіміко-технологічних процесів
- •6.1. Рівновага хімічних реакцій
- •6.2. Константа рівноваги й енергія Гіббса. Рівняння ізотерми Вант-Гоффа
- •6.3. Хімічна рівновага в гетерогенних реакціях
- •7. Вибір технологічних режимів проведення хтп
- •7.1. Способи зміщення рівноваги
- •7.2. Залежність константи рівноваги від температури
- •7.3. Розрахунок рівноваги за термодинамічними даними
- •8. Використання законів хімічної кінетики при виборі технологічного режиму.
- •8. 1. Швидкість гомогенних хімічних реакцій
- •8.2. Залежність швидкості хімічних реакцій від концентрації реагентів; кінетичні рівняння
- •8.3. Способи зміни швидкості простих і складних реакцій
- •9. Кінетика хіміко-технологічних процесів
- •9.1. Вплив різних чинників на швидкість хімічних процесів, які перебігають на мікрорівні
- •9.2. Кінетика хтп, що ґрунтується на оборотних хтп
- •9.3 Швидкість хтп, що ґрунтується на паралельних та послідовних гомогенних реакціях
- •9.3.2. Вплив технологічних параметрів на швидкість гомогенних процесів
- •9.3.3. Методи інтенсифікації гомогенних процесів
- •9.4. Кінетика гетерогенних некаталітичних процесів
- •9.4.2. Швидкість гетерогенних процесів
- •9.4.4. Визначення лімітуючої стадії гетерогенного процесу
- •9.4.5. Способи збільшення швидкості процесу
- •9.5 Типи реакторів для гетерогенних процесів
- •9.5.1 Реактори для проведення реакцій в системах г-т і р-т
- •9.5.2 Реактори для проведення реакцій в системах г—р і р—р
- •10. Каталітичні процеси.
- •10.2. Технологічні характеристики каталізаторів
- •10.3. Гомогенний і гетерогенний каталіз
- •10.4. Властивості твердих каталізаторів і їхнє виготовлення
- •10.5. Апаратурне оформлення каталітичних процесів
- •10.5.3 Апарати зі зваженим (киплячим, псевдокиплячим) шаром каталізатора
- •11. Хімічні реактори
- •11.1 Класифікація реакторів
- •11.2. Вимоги до хімічних реакторів
- •11.3. Структура математичної моделі хімічного реактора
- •10.4. Реактор ідеального змішування періодичний
- •11.5 Реактори безперервної дії
- •11.5.1 Реактор ідеального витіснення (рів)
- •11.5.2. Реактор ідеального змішування безперервний (різ–б)
- •11.5.3 Загальне проектне рівняння реактора
- •11.6 Каскад реакторів ідеального змішання (к-різ)
- •11.7 Графічний метод розрахунку к – різ
- •11.8. Вплив кінетики на вибір типу реактора
- •11.9. Селективність, вихід, ступінь перетворення
- •11.9.2. Залежність селективності від ступеня перетворення
- •11.10. Хімічні реактори з неідеальною структурою потоків
- •11.11. Моделі ректорів з неідеальною структурою потоку
- •11.12. Ячеїста модель.
8.3. Способи зміни швидкості простих і складних реакцій
Як уже вказувалося, швидкість хімічної реакції залежить від великої кількості різних факторів. З кінетичних рівнянь слідує насамперед, що швидкість простої реакції пропорційна концентраціям речовин, що є реагентами в даній реакції. Отже, для простих реакцій збільшення концентрації вихідних речовин практично завжди приводить до збільшення швидкості (за винятком реакцій нульового порядку, швидкість яких не залежить від концентрації). Якщо реакція, що описується стехіометричним рівнянням (8.10), характеризується частинними порядками, що розрізняються, за компонентами А и В, то найбільший вплив на швидкість реакції буде робити зміна концентрації реагенту, що має більший частинний порядок. Наприклад, якщо кінетичне рівняння реакції, у якій беруть участь два реагенти, має вигляд =kC2AC0,25B,. то збільшення концентрації реагенту А в 2 рази викличе зростання швидкості в 4 рази, а двократне збільшення концентрації реагенту В приведе до збільшення швидкості лише в 1,19 рази. Для складних реакцій, зокрема для паралельних, питання про вибір концентрацій реагентів для керування процесом також не є однозначним. Розглянемо для приклада систему з двох паралельних реакцій різного порядку (за сталої температури):
a1A rR
a2A sS (8.20)
Говорячи про збільшення швидкості такої реакції, потрібно спочатку вирішити, яка реакція більше важлива, тобто яка реакція приводить до утворення потрібного цільового продукту. Нас цікавить найчастіше не те, наскільки швидко витратиться реагент А, а наскільки швидше цільовий продукт буде утворюватися в порівнянні з побічним продуктом.
Нехай у розглянутому прикладі цільовим є продукт першої реакції R, а побічним - продукт S.
Для аналізу співвідношення швидкостей цільового й побічного процесів користуються миттєвою або диференціальною селективністю, рівної відношенню швидкості витрати реагенту А на цільову реакцію до загальної швидкості витрати реагенту на цільову і на побічні реакції.
φ’=υ(A![]() R)
υA (8.21)
R)
υA (8.21)
Значення диференціальної селективності в ході процесу в загальному випадку не залишається сталим, тому що воно визначається відношенням швидкостей реакцій, а швидкість реакції в міру її перебігання змінюється. Таким чином, диференціальна селективність характеризує ефективність цільової реакції в деякий момент часу за деякого значення концентрацій реагентів і продуктів і за заданої температури. Лише в тому випадку, коли параметри процесу в часі й просторі не змінюються (це можливо за проведення процесу в стаціонарному реакторі ідеального змішання), φ' залишається сталою величиною.
При перебіганні хімічної реакції міняються концентрації реагентів і продуктів. Розглянемо, як при зміні концентрації вихідного реагенту А для системи паралельних реакцій (8.18.) за сталої температури процесу міняється диференціальна селективність φ'.
Нехай цільова реакція має за вихідним реагентом А порядок n1, а побічна реакція – n2, тоді:
υ![]() ,
,
υA![]() ,
,
φ΄= . (8.22)
. (8.22)
Проаналізуємо залежність φ' від концентрації реагенту А. Для зручності перетворимо вираз (8.22):
φ΄= (8.23)
(8.23)
Тут λ=к2/k1 - величина, що не залежить від концентрації реагенту А; Δn= n2–n1- різниця порядків побічної й цільової реакцій за вихідним реагентом А. Очевидно, що φ΄ може бути як зростаючою, так і зменшуючою функцією від концентрації. Визначимо характер функції φ'(СА) за знаком першої похідної:
 (8.24)
(8.24)
Як видно з рівняння (8.24), знак першої похідної залежить від знака Δn(λ=k2/k1-завжди позитивна, СА в будь-якому ступені також позитивна величина). Якщо Δn < 0, тобто якщо n1 > n2 (порядок цільової реакції за вихідним реагентом більше порядку побічної реакції), то φ'(СА) - зростаюча функція; швидкість цільової реакції з ростом концентрації вихідного реагенту зросте значно швидше швидкості побічної й частка швидкості цільової реакції у сумарній швидкості зросте (рис. 8.1, крива 2).
У цьому випадку бажаний результат - збільшення швидкості утворення побічного продукту R у порівнянні зі швидкістю утворення побічного продукту S (збільшення диференціальної селективності φ') - досягається при використанні вихідного реагенту високої концентрації. За Δn > 0 (n1 < n2) характер залежності φ' від концентрації вихідного реагенту протилежний: dφ'/dcA<0, отже, φ'(СА)- функція (рис. 8.1, крива 1), яка знижується, і більше висока диференціальна селективність за цільовим продуктом досягається за низької концентрації вихідного реагенту. Отже, не завжди вигідно прагнути збільшувати концентрацію реагенту. Правда, при низьких концентраціях реагенту невеликим буде абсолютне значення швидкості за інших рівних умов. Тоді потрібно шукати інші шляхи збільшення швидкості реакції за збереження високого значення диференціальної селективності. За Δn=0 диференціальна селективність, як це видно з рівняння (8.24.), залишається сталою величиною за любих значень концентрації вихідних реагентів, і змінити φ' можна, лише змінивши співвідношення k2/k1.

Рис. 8.I. Залежність диференціальної селективності від концентрації вихідного реагенту А для паралельних реакцій при різних співвідношеннях порядків реакцій n1 і n2:
1-n1=1; k1=10 год-1; n2=2,5; к2=15 м4,5/(кмоль1,5 год.); 2-n1=2,5; к1=15м4,5/(кмоль1,5 год.); n2=1; к2=10 год-1.
Найпростіше вплинути на це співвідношення, змінивши температуру проведення реакції, тому що температура є одним з технологічних параметрів, , що найбільшою мірою впливає на швидкість хімічної реакції. Розглянемо вплив температури на швидкість хімічної реакції більш докладно.
Експериментально при вивченні кінетики хімічних реакцій було виявлено, що при збільшенні температури на 10 градусів швидкість реакції збільшується в 2—4 рази. Більш строго ця залежність виражається у вигляді рівняння Арреніуса:
k=k0exp[-E/(RT)], (8.25)
де k - константа швидкості реакції; R - універсальна газова стала; Т - температура; k0 - передекспоненційний множник; Е - енергія активації реакції.
Енергія активації елементарної реакції Е - це мінімальний надлишок енергії над середньою внутрішньою енергією молекул, необхідний для того, щоб відбулася хімічна взаємодія (енергетичний бар'єр, що повинні подолати молекули за переходу з одного стану реакційної системи в інший).
Для оборотних реакцій різниця енергій активації прямої (E1) і зворотної (Е2) реакцій дорівнює тепловому ефекту реакції.
Передекспоненційний множник k0 ураховує число зіткнень, імовірність розпаду активованого комплексу реакції на вихідні реагенти без утворення продуктів реакції, просторову орієнтацію молекул реагентів, а також ряд інших факторів, що впливають на швидкість реакції й не залежать від температури.
При більше строгому розгляді варто врахувати, що k0 також залежить від температури, але за температур, коли RT << Е, з досить гарним наближенням цією залежністю можна знехтувати.*
Часто рівняння Арреніуса представляють у вигляді лінійної залежності логарифма константи швидкості від зворотної температури: lnk=f(1/Т). У такому вигляді зручно провести його аналіз.
На рис. 8.2 у координатах ln k – 1/T представлена температурна залежність константи швидкості реакції. З аналізу цієї залежності можна зробити наступні висновки.
По-перше, з нерівномірності температурної шкали, відкладеної на осі абсцис, слідує, що хімічні реакції більше чутливі до змін температури в області більш низьких температур. На прямій 1, що відповідає хімічній реакції з енергією активації 165 кдж/моль, обрані дві ділянки /Ι і ΙΙ /, що характеризуються однаковою зміною температури (ΔТ=100 К), але в різних температурних інтервалах: ділянка I - в області температур, близьких до кімнатної, ділянка II - в області більше високих температур (~573 К). Для ділянки I за зміни температури на 100 К константа швидкості реакції k1, збільшується в 1,9 107 разів, для ділянки II при тім же ΔT спостерігається збільшення константи швидкості лише в 820 разів, тобто на ~4 порядки нижче, ніж на ділянці I.
Другий важливий висновок випливає з порівняння температурних залежностей швидкостей реакцій з різними значеннями енергії активації. Чим вище енергія активації реакції, тим більше чутлива вона до змін температури. На рис.8.2. наведені температурні залежності для реакцій з енергіями активації 165 кдж/моль (пряма 1) і 40 кдж/моль (пряма 2).
За зміни температури від 500 до 600 К швидкість першої реакції (Е =165 кдж/моль) збільшується в 820 разів (ділянка II), а швидкість другої реакції (Е =40 кдж/моль) - лише в 5,3 рази (ділянка III). Останній висновок надзвичайно важливий при виборі умов проведення складних (паралельних і послідовних) реакцій. Розглянемо, наприклад, вплив температури на диференціальну селективність для паралельних реакцій (8.18.):
φ΄= (8.26.)
(8.26.)
Для того щоб виділити тільки вплив температури на селективність, приймемо, що цільова й побічна реакції мають однаковий порядок (n1=n2). Перетворимо рівняння (7.23) з урахуванням рівняння (7.21):
φ΄=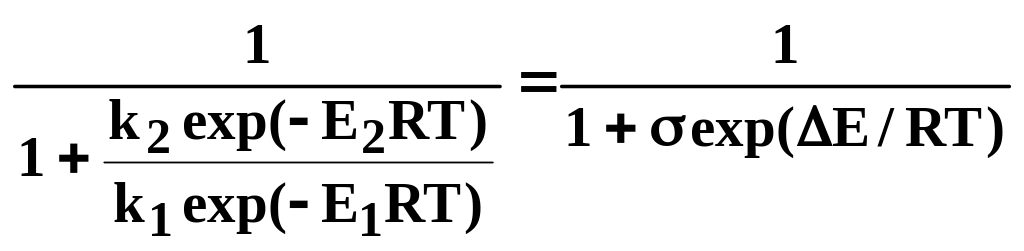 (8.27)
(8.27)
Для більшості ХТП Е=80−100 кДж/моль. Отже, за звичайних для проведення хімічних реакцій температур від 300 до 1000 К величина RT, яка характеризує теплову енергію молекул, в 20-70 разів менше Е.
Зневажаючи слабким впливом температури на передекспоненційні множники в рівнянні Арреніуса, рахуємо, що σ=k2,0/k1,0 від температури не залежить. Похідна:
+
позитивна, якщо ΔЕ=Е1-Е2 > 0, і негативна, якщо ΔЕ<0.
Таким чином, якщо енергія активації цільової реакції перевищує енергію активації побічної реакції, то з ростом температури спостерігається ріст диференціальної селективності, тобто відносно більше швидке збільшення швидкості цільової реакції в порівнянні зі збільшенням швидкості побічної реакції й сумарної швидкості процесу. Навпаки, якщо Е1<Е2, для збільшення диференціальної селективності φ' потрібно знижувати, а не підвищувати температуру.
З рівняння Арреніуса видно, що принципово можливий ще один шлях керування швидкістю хімічної реакції - зміна величини
Е - енергії активації реакції.
Висота енергетичного бар'єра реакції тісно пов'язана з її механізмом. Якщо змінити шлях реакції, направивши її до кінцевих продуктів через деякі нові проміжні комплекси, то можна змінити й значення енергії активації. Такий шлях можливий при застосуванні каталізаторів. З наведеного вище розгляду впливу температури на швидкість реакцій з різною енергією активаціїслідує, щоб у випадку застосування каталізатора для прискорення цільового процесу при проведення паралельних реакцій можлива така ситуація, коли енергія активації побічної реакції виявиться вище енергії активації цільової реакції, і тоді збільшення температури, яке часто застосовується для інтенсифікації хіміко-технологічних процесів, приведе до зниження селективності за цільовим продуктом.

Рис. 8.2. Температурна залежність константи швидкості хімічної реакції для реакцій з енергіями активації 165 кДж/моль (1) і 40 кДж/ моль (2): ділянка I - зміна ln k за збільшення температури з 300 до 400 К; ділянка II те ж, при збільшені температури з 500 до 600 К; ділянка III - зміна ln k для реакції з низькою енергією активації при зміні температури з 500 до 600 К.
