
- •6.Другий закон термодинаміки. Доведення його за допомогою циклу Карно. Ккд
- •4.Теплота і робота. Перший закон термодинаміки та висновки з нього.
- •19. Швидкість хімічної реакції .Рівняння Арреніуса.
- •5.Закон Гесса та висновки з нього.
- •8.Закон Рауля та відхилення від нього.
- •9. Закони коновалова. Розділення сумішей шляхом перегонки.
- •10. Ебуліоскопія
- •11. Кріоскопія
- •12. Явище осмосу. Осмотичний тиск. Біологічна роль.
- •1. Агрегатні стани речовин. Ідеальні та реальні гази. Основні закони ідеальних газів.
- •3. Закон Шарля
- •4. Закон Авогадро.
- •15.Основні поняття:фаза,компонент,ступінь вільності.Правило фаз Гіббса.Однокомпонентні системи.
- •22.Дисперсні системи, основні поняття.Класифікація дисперсних с-м.
- •24.Коагуляція колоїдних розчинів електролітами. Поріг коагуляції. Правило Панета-Фаянса. Механізми коагуляції.
- •25. Молекулярно-кінетичні та оптичні властивості дс.
- •18. Гальванічні елементи
- •16. Застосування правила фаз Гіббса. Двокомпонентні системи. Діаграми стану двокомпонентних систем.
- •20.Каталітичні процеси. Явище каталізу .Види каталізу. Промотори та інгібітори. Їх застосування в промислових процесах.
- •12.Робота різних процесів для одного моля ідеального газу.
- •7.Ентропія.М-ди розрахунку ентропії для різних процесів.Абсолютне значення ентропії.Постулат Планка.
24.Коагуляція колоїдних розчинів електролітами. Поріг коагуляції. Правило Панета-Фаянса. Механізми коагуляції.
Зміна певних умов призводить до коагуляції золю. При введенні в р-н золю одночасно більше 1-го ел-ту може спостерігатися різна коагуляційна здатність.Н-д: при дод. суміші 2-х ел-тів спостер. таке явище як:
1.Адитивність Ссум= Сел1+Сел2; Ссум=70%КСl+30%NaCl
2. Синергізм Ссум< Cел1+Cел2 ; Cсум=70%LiCl+10%CsCl
3.Антагонізм Ссум >Сел1+Сел2 Cсум=70%KlCl+50%CaCl2
Найменша к-сть ел-ту, яка викликає коагуляцію одиниці об’єму золю наз. порогом коагуляції (Ск.)
Ск=ел/Vзолю Ск=моль/л.
Механізми коагуляції:
1. Мех.-м концентраційної коагуляції спостеріг-ся при дод. надл ПрВі міцели(дод іонів К+) або надл ПВІ(дод І-)
а) індиферентні іони (К+)
б) неіндиферентних іонів (І-) до золю.
mAgInI-(n-x)K+-xx K+
Стійкість золю буде хар-ся наявністю заряду гранули , а відповідно і якомога більшою величиною ел. Хім.. пот-лу s.
2. Мех.-м нейтралізаційної коагуляції. Даний мех.-м спостер в-к повної нейтралізації ПВІ або індефер іонами з більшою валентністю(дод Fe3+, Al3+), або неіндеф іонів (дод Ag+).
Ф.Х.
25. Молекулярно-кінетичні та оптичні властивості дс.
Харктерною властивістю вільнодисперсних систем є схильність до осідання або вспливання часточок. Осідання називається седиментацією, а вспливання─ зворотньою седиментацією. Здатність до седиментації виражають через константу седементації, яка для сферичних частинок рівна:
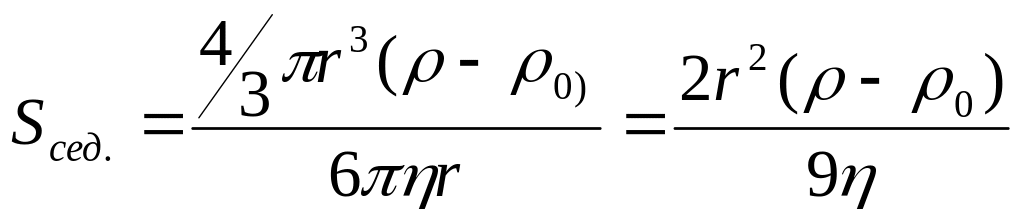
тобто константа седиментації залежить не лише від розмірів частинок, але і від природи фаз.
Наступною кінетичною (молекулярно-кінетичною) властивістю є броунівський рух. Природа даного руху була доказана Ейнштейном і Смолуховським, які вивели закон :квадрат зсуву пропорційний коефіцієнту дифузії і часу:
![]() В─коефіцієнт
тертя
В─коефіцієнт
тертя
електроосмос (електрокінетична властивість)─ переміщення рідини в пористих тілах під дією електричного поля. Швидкість електроосмотичного руху описується рівнянням гальмгольца-Смолуховського:
![]() або
або
![]()
Електрофорез─ переміщення частинок дисперсної фази в електричному полі.
Оптичні властивості золю визначаються властивостями колоїдних частинок, тому вивчаючи оптичні властивості системи, можна встановити розмір, форму і будову частонок, які не видно в звичайний мікроскоп.
При падінні променю світлана дисперсну систему можуть спостерігатись наступні явища:
Проходження світла через систему
Заломлювання світла часточками дисперсної фази
Відбивання світла частинками ДФ
Розсіювання світла (опалесценція)
Абсорбція (поглинання) світлу ДФ з перетворенням світлової енергії в теплову.
Розсіювання світла. Інтенсивність розсіяного світла в різних напрямках різна. Якщо частинки малі в порівнянні з довжиною хвилі, більше всьго світла розсіюється під кутом в 0 і 180˚ до променю падаючого на частинку. Якщо частинки великі (але менші ніж довжина світлової хвилі), максимальна кількість світла, що розсіюється в направлені падаючого променю. Крім того, розсіяне світло найчастіше поляризоване. При цьому для малих часточок світло, розсіяне під кутом в 0 і 180˚ , поляризоване зовсім, а світло, що розсіяне під кутом 90˚ , поляризоване повністю, для великих часточок максимальна поляризація спостерігається при куті, що відрізняється від 90˚.
Для сферичних частинок малих по відношенню до довжини хвилі було виведено рівняння (рівняння Реллея):
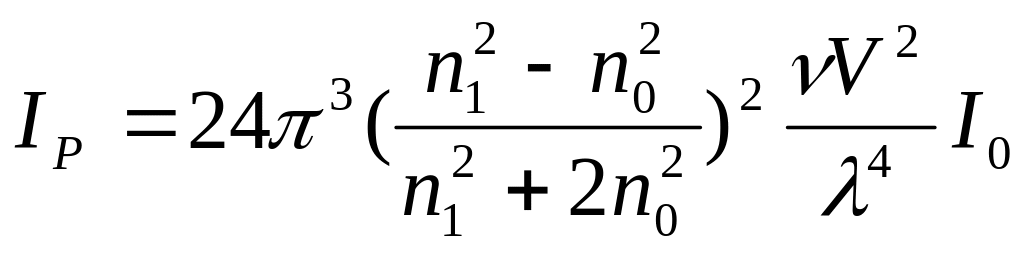 дане рівняння
дане рівняння
n1 i n0─ показники заломлення дисперсної фази і дисперсного середовища, ν─ чисельна концентрація,V─ об”єм однієї частинки, λ─довжина хвилі.
застосовують, коли розмір частинок складає не більше 0,1 довжини хвилі. При збільшенні частинок більше визначеного розміру відбивання світла від часточок збільшується, що призводить до зменшення інтенсивності розсіяного світла. Розом з цим по мірі зменшення частинок інтенсивність світлорозсіювання також падає. Тому максимальним світлорозсіюванням володіють колоїдні системи.
Абсорбція світла. Закон поглинання світла Бугера-Ламберта-Бера: ln(I0/In)=εCl, що був виведений для гомогених систем, можна застосовувати і для золей високої дисперсності, при умові невеликого шару рідини. але металеві золі у відношені абсорбції проявляють аномальну поведінку в порівнянні з іншими колоїдними розчинами. Таму для металевих золей рівняння світлопоглинання повинно враховувати дисперсність:
In=I0exp[─εCl/f(r3)], але при рості дисперсності часточки стають настількт малі, що вже не заважають проходженю світла, і цьому випадку поводять себе як істинні розчини.
Оптичними методами досл є:
1. Ультрамікроскопія. Відрізняється від звичайної мікроскопії тим, що при спостереженні кол р-ну в-к пропускання пучка променів світла, сам фон(кол р-н) буде темним, а кол част-ки(ДФ) будуть світитися.
2.Нефелометрія- ґрунтується на порівнянні розсіюваного світла стандартного р-ну(чисте ДС-ще) та його розсіюв у досліджуваному кол р-ні.. Описується р-ням Бугера- Ламберта- Бера: Ір=Іо-kd d- товщина кювети; k- константа, яка залеж від ф-рів розсіювання.
3. Турбідиметрія.- м-д кількісного хім. аналізу, заснований на вимірюванні інтенсивності світла, поглиненого зваженими частинками середовища.
Ф.Х.
