
- •6.Другий закон термодинаміки. Доведення його за допомогою циклу Карно. Ккд
- •4.Теплота і робота. Перший закон термодинаміки та висновки з нього.
- •19. Швидкість хімічної реакції .Рівняння Арреніуса.
- •5.Закон Гесса та висновки з нього.
- •8.Закон Рауля та відхилення від нього.
- •9. Закони коновалова. Розділення сумішей шляхом перегонки.
- •10. Ебуліоскопія
- •11. Кріоскопія
- •12. Явище осмосу. Осмотичний тиск. Біологічна роль.
- •1. Агрегатні стани речовин. Ідеальні та реальні гази. Основні закони ідеальних газів.
- •3. Закон Шарля
- •4. Закон Авогадро.
- •15.Основні поняття:фаза,компонент,ступінь вільності.Правило фаз Гіббса.Однокомпонентні системи.
- •22.Дисперсні системи, основні поняття.Класифікація дисперсних с-м.
- •24.Коагуляція колоїдних розчинів електролітами. Поріг коагуляції. Правило Панета-Фаянса. Механізми коагуляції.
- •25. Молекулярно-кінетичні та оптичні властивості дс.
- •18. Гальванічні елементи
- •16. Застосування правила фаз Гіббса. Двокомпонентні системи. Діаграми стану двокомпонентних систем.
- •20.Каталітичні процеси. Явище каталізу .Види каталізу. Промотори та інгібітори. Їх застосування в промислових процесах.
- •12.Робота різних процесів для одного моля ідеального газу.
- •7.Ентропія.М-ди розрахунку ентропії для різних процесів.Абсолютне значення ентропії.Постулат Планка.
3. Закон Шарля
V=const – ізохорний процес
Для даної маси ідеального газу при сталому V, зміна температури на 1° С призводить до зміни на 1⁄ 273,16 його початкового об’єму виміряного при 0° С.
Pt = P0 (1 + 1/273, 16 * t)
Якщо 1/273, 16 = β тоді Pt = P0 (1 + β * t)
P=f(t) – ізохора
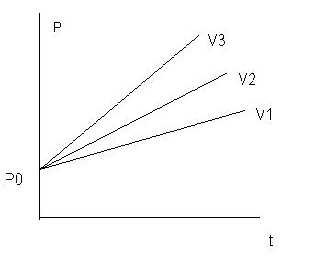
Абсолютна температура Т – це температура, початкове значення якої приймається за 0 К, при якому тиск газу буде також рівний 0.
Для даної маси ідеального газу при сталому об’ємі відношення тисків ідеального газу будуть прямо пропорційні їх абсолютним температурам.
Р1/Р2=Т1/Т2
Для даної маси ідеального газу при сталому об’ємі концентрація і густина ідеального газу будуть обернено пропорційні їх абсолютним температурам
С1/С2=Т2/Т1
4. Закон Авогадро.
Одинакові об’єми різних газів при однакових умовах містять однакову кількість молекул.
NA=6.025*1023 молекул / моль
Питомий об’єм ідеального газу Vпит=22.4 / M
Питома густина ρ пит= m/V = M/Vm
Р-ння стану ідеального газу одержане внаслідок обєднання всіх законів.
PV/T=const
P1V1/T1=P2V2/T2
Використовується для приведення газу до н.у.
PV/T=P0V0/T0
Так як ρ=1/V тоді P/Tρ=P0/T0ρ0
Закон Мендєлєєва-Клапейрона
PV=nRT
N=m/M
PV=(m/M)RT
Якщо даний об’єм ідеального газу, то n=P1V1/RT1
Ф.Х.
2. Реальні гази. Рівняння стану реального газу.
Реальний газ – це газоподібний стан речовини, який відповідає наступним ознакам:
Між молекулами існують сили міжмолекулярної взаємодії.
Молекули мають власний об’єм.
Молекули рухаються хаотично.
До реальних газів не можна використовувати закони ідеальних газів. Але понижуючи тиск можна кожен газ привести до стану ідеального.
Закони ідеальних газів краще всоьго відображають поведінку тих газів, якінайбільш важко стискаються, наприклад водень, гелій, неон. А для легкозріджуючихся газів діоксиду вудлецю, діоксиду сірки, відхилення спостерігаються і при нормальному тиску.
Фактори, які впливають на відхилення від законів ідеальних газів: взаємне притягання молекул і існування власного об’єму. Взаємне притягання послаблюється при збільшенні відстаней між молекулами, але при сильному зближенні молекул взаємне притягання досягає максимума. Потім швидко послаблюється і переходить у відштовхування. Для газів, що знаходяться при сталому зовнішньому тиску, взаємне притягання молекул призводить до до зменшенню об’є му, що займає газ. А наявність власного об’єму молекул зменшує простір між ними і відповідно зменшує довжину вільного пробігу молекул.
Ці фактори враховує рівняння стану реального назу ─ рівняння ван-дер-Ваальса:
![]() .величина
a/V2
виражає
поправку, що враховує взаємне притягання
молекул, яке діє як деякий тиск К=а/V2,
який стискує газ. Його називають
внутрішнім тиском . величина b
виражає поправку, що враховує власний
об’єм
молекул і взаємне відштовхування між
ними. Величини а і b
залежать від температури і тиску. В
межах достатньо великих об”ємів ці
члени втрачають своє значення і дане
рівняння переходить в рівняння стану
ідеального газу: pV=nRT
.величина
a/V2
виражає
поправку, що враховує взаємне притягання
молекул, яке діє як деякий тиск К=а/V2,
який стискує газ. Його називають
внутрішнім тиском . величина b
виражає поправку, що враховує власний
об’єм
молекул і взаємне відштовхування між
ними. Величини а і b
залежать від температури і тиску. В
межах достатньо великих об”ємів ці
члени втрачають своє значення і дане
рівняння переходить в рівняння стану
ідеального газу: pV=nRT
Ф.Х.
13.Фазові переходи індивідуальних речовин першого та другого роду.Термодинаміка фазових переходів.
До фазових переходів індивідуальних речовин першого роду належать:
агрегатні перетворення речовин(плавлення,випаровування,конденсації,сублімації ітд.)Для них характерні 3 ознаки:
1.перетворення індивідуальних речовин супроводжується стрибкоподібною зміною об’єму.
V1≠V2; V≠0
2.стрипкоподібною зміною мольної або питомої ентропії.
S1 ≠S2; S≠0
3.характеризується рівністю ізобарно-ізотермічного потенціалів речовини в стані динамічної рівноваги,тобто
G1=G2; G=0
Наприклад: лід- вода -пара.
Фазові перетворення інд. речовин другого роду,характеризуються слідуючими 3-ма ознаками:
1.рівністю об’ємів обох фаз речовини
V1=V2; V=0
2.сталістю величини мольної або питомої ентропії
S1 =S2; S=0
3.рівністю ізобарно-ізотермічного потенціалу в стані рівноваги
G1=G2; G=0
До таких перетворень належать перетворення всередині однієї фази.
Наприклад:перетворення феромагнітних властивостей в діамагнітні,вище точки Кюрі,сюди ж належать виникнення надпровідності в металах при наближенні до абсолютного нуля.
Розглянемо с-му лід-вода при сталому Р(тиску). Фазове перетворення індивідуальних речовин 1-го роду,характеризується зміною ізобарно-ізотермічного потенціалу.
ля першої фази зміна становитиме
dG1 =-SdT+Vdp
для 2-гої
dG2=-SdT+Vdp
так як в момент рівноваги dG1= dG2,прирівнявши праві іліві частини одержуємо: S=dT(V1-V2)dp(3)
Згідно2-го закону термодинаміки S=Q ∕T=λ∕T(4)
Q-прихована теплота фазового переходу
λ –мольна прихована теплота фазового перетворення.Вираз 4 підставимо у вираз 3,звідки одержимо:
λ=T(V1-V2)dp∕dt-р-ня Клапейрона-Клаузіуса для 1-го моля речовини.
Так як λ∕М=L-питома прихована теплота фазового перетворення.
L=T(V2-V1)∕M ·dp∕dt-р-ня клапейрона-Клаузіуса для 1-го грама речовини.
Ф.Х.
14.Застосування рівняння Клапейрона-Клаузіуса до процесів плавлення та випаровування.
Розглянемо с-му тверда фаза-рыдка фаза
λ=T(V1-V2)dp∕dt. На процес плавлення завжди затрачається тепло ззовні,тому мольна прихована теплота плавлення- λ,завжди буде величина додатня. Тпл.-величина додатня.Для більшості речовин V рідк.фази > вихідної твердої,тоді різниця цих об’ємів також додатня (V1-V2>0).Це означає,що dp∕dt також > 0
Отже,по мірі збільшення зовні.P величина Тпл.індив.речовини теж зростає.
Проте,для леяких р-н:води і тд.V2<V1,тоді dp∕dt є величина негативна і при збільшенні зовн.Р, знижуєт.Тпл.,дане явище х-не для Вісмуту,Галію,деяких сортів чавуну.
Для п-цесів випаровування х-на с-ма, рідка фаза-пара.На процес випаровування теж затрачається теплота ззовні,тому λ>0, Ткип.теж додатня,так як Vпари завжди > від Vвих.рідини,то V2-V1>0.Отже по мірі збільшення зовн.Р,Ткип.завжди зростає.
При температурах набаг. вищих від Ткип. Рідини реальна пара переходить в ідеальний газ,тобто V2>>V1,тому початковим об’ємом можна знехтувати.Тоді λвип.=TV2dp∕dt.,де V2 – об’єм газоподібної фази.
Λвип=RT2∕P · dp∕dt-р-ня Клапейрона-Клаузіуса для процесу випаровув. 1-го моля індивід. р-вини.
Ф.Х.
