
- •6.Другий закон термодинаміки. Доведення його за допомогою циклу Карно. Ккд
- •4.Теплота і робота. Перший закон термодинаміки та висновки з нього.
- •19. Швидкість хімічної реакції .Рівняння Арреніуса.
- •5.Закон Гесса та висновки з нього.
- •8.Закон Рауля та відхилення від нього.
- •9. Закони коновалова. Розділення сумішей шляхом перегонки.
- •10. Ебуліоскопія
- •11. Кріоскопія
- •12. Явище осмосу. Осмотичний тиск. Біологічна роль.
- •1. Агрегатні стани речовин. Ідеальні та реальні гази. Основні закони ідеальних газів.
- •3. Закон Шарля
- •4. Закон Авогадро.
- •15.Основні поняття:фаза,компонент,ступінь вільності.Правило фаз Гіббса.Однокомпонентні системи.
- •22.Дисперсні системи, основні поняття.Класифікація дисперсних с-м.
- •24.Коагуляція колоїдних розчинів електролітами. Поріг коагуляції. Правило Панета-Фаянса. Механізми коагуляції.
- •25. Молекулярно-кінетичні та оптичні властивості дс.
- •18. Гальванічні елементи
- •16. Застосування правила фаз Гіббса. Двокомпонентні системи. Діаграми стану двокомпонентних систем.
- •20.Каталітичні процеси. Явище каталізу .Види каталізу. Промотори та інгібітори. Їх застосування в промислових процесах.
- •12.Робота різних процесів для одного моля ідеального газу.
- •7.Ентропія.М-ди розрахунку ентропії для різних процесів.Абсолютне значення ентропії.Постулат Планка.
12. Явище осмосу. Осмотичний тиск. Біологічна роль.
Явище осмосу виникає тоді коли розчин межує або з чистим розчинником, або з р-ном іншої концентрації.
Осмос – це явище самовільної, односторонньої ,дифузії молекул розчинника через на пів проникливу перегородку в р-н більшої концентрації.
А) Б)
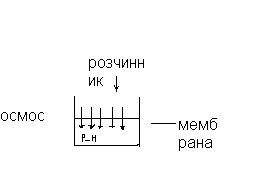
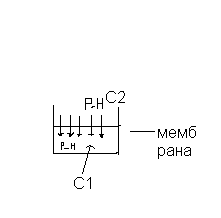
В якості мембрани можуть використовуватися целофан, інші полімери, пергамент, шкіра.
Роль мембрани.
За рахунок наявних отворів у мембрані відбувається переміщення молекул розчинника з розмірами меншими, або спів розмірними отворам.
Осмотичний тиск Р осм. – це тиск який створюють молекули розчинника, в наслідок осмосу на одиницю поверхні мембрани.
Величину осм. тиску вимірюють за допомогою приладів осмометрів.
Експериментально величину Р ос. вимір. як гідростатичний тиск, який необхідно прикласти на зустріч осмосу, щоб повністю припинити його.
Для теоретичних розрахунків Р ос викор з-н Вант- Гофа
Осмотичний тиск р-ну неелектроліту буде = тому газовому тиску, який би створила розчинена речовина якби вона у вигляді газу займала той самий об’єм який займає розчин.
Так як Вант- Гоф прирівняв р-н до газу, то застосувавши р-ня Мін діл –Клапейрона для ідеальних газів:
РV = nRT
P = n/V * RT - для газів
P осм = CM * RT - для розчинів
Длля розчинів електролітів P осм = і * CM * RT
Біологічне значення осмосу.
Якщо клітину помістити в р-н меншої концентрації ніж концентрація внутрішньоклітинного р-ну, то починає самовільно виникати явище осмосу, тобто проникнення молекул розчинника із зовнішнього розчину в середину клітини. При цьому клітина набухає і більш щільно прилягає до целюлозних стінок клітини. Явище набухання назив тургором, а явище проникнення молекул розчинника в середину клітини – ендосмосом.
- Якщо клітину помістити в р-н більшої концентрації то виникатиме явище осмосу зумовлене проникненням молекул розчинника зсередини клітини у зовнішній р-н –екзоосмос.
Клітина ж при цьому зморщується та зсихається, якщо процес триває довго. Це явище називають плазмолізом.
Для високоорганізованих тварин і людини Р осм. = 8 атм.
-Розчини які мають однакове значення Р осм. – назив Ізотонічними. До них належать фізіологічні р-ни (глюкоза)
-Р-н який має більший осмотичний тиск ніж даний назив – Гіпертонічним.
-Р-н який має менший Р осм. ніж даний назив Гіпотонічним
Ізотонічні р-ни викор в медицині , (вводяться внутрішньовенно).
Гіпертонічні р-ни викор тільки у вигляді зовнішніх марлевих повязок при лікуванні гангрени або гнійних ран.
Ф.Х.
1. Агрегатні стани речовин. Ідеальні та реальні гази. Основні закони ідеальних газів.
Більшість речовин залежно від умов можуть існувати в різних агрегатних станах. Проте для деяких речовин неможливо одержати за жодних умов певного агрегатного стану. Н: СаСО3 - неможливо досягти рідкого та газоподібного стану бо в процесі нагрівання він руйнується.
СаСО3 = СаО + СО2
Але в той же час деякі речовини можуть одночасно співіснувати в декількох агрегатних станах.
Н: Р, Н2О,S.
Перехід речовини з рідкого стану в газоподібний – випаровування. Зворотній до нього процес – конденсація.
Перехід речовини з твердого в рідкий – плавлення.
Зворотній - затвердівання.
Сублімаціч – перехід з твердого стану в газоподібний, а зворотній десублімація( конденсація).
Поліморфне перетворення – це перехід з однієї модифікації речовини в іншу, при одному і тому ж агрегатному стані.
Газоподібний стан – хар. дуже слабою взаємодією між молекулами в наслідок чого газ завжди займає весь наданий йому об’єм. Тому він легко змінює форму і об’єм.
Рідкий стан – хар. порівняно більшими міжмолекулярними силами, тому молекули втрачають здатність рухатись незалежно одна від одної і віддалятись на значну відстань, в результаті рідина легко змінює форму і практично не змінює свого об’єму.
Твердий стан –хар. впорядкованим розташуванням молекул, атомів або іонів з утворенням кристалічної гратки. Хар. великими силами міжмолекулярної взаємодії і тому не можливо змінити ні форму ні об’єм твердого тіла не зруйнувавши його.
Плазма – це суміш іонів, радикалів та електронів, оголених ядер і продуктів їх розкладу. В стан плазми газ може переходити під впливом різних факторів: а) при високих температурах( сотні тисяч); б) під впливом електричного розряду ; в) під впливом рентгенівського опромінення ; …
Ступінь іонізації плазми хар. величиною α Залежно від ступеня іонізації розрізняють наступні види плазми:
якщо α < 1% слабо іонізована;
якщо α < 1%< 10% помірно іонізована;
якщо α = 100% повністю іонізована.
Наявність у плазмі позитивно заряджених іонів та електронів зумовлює її високу електропровідність.
Плазма – це газ, що світиться. Явище світіння зумовлене енергетичними переходами електрона з одного рівня на інший.
Технічне використання плазми зумовлене можливістю керованої її енергії( «Керована термоядерна реакція» -Сахаров) .
Основні закони ідеального газу.
Ідеальний газ – це гранично розріджений стан газу для якого хар. 3 ознаки. А) між молекулами не існує сил взаємодії.
Б) Молекули не мають власного об’єму, тобто розмірами їх можна знехтувати і розглядати, як математ. точки.
В)молекули рухаються хаотично.
Стан газоподібного тіла, як і будь - який інший агрегатний стан хар. 3 – ма основними параметрами: Р, V, t.
з-н Бойля – Маріотта
Для даної маси ідеального газу при сталій температурі добуток тиску на обєм є величина стала.
Р * V = const
Р 1* V1 = Р2 * V2
Р = f (V)
Для даної маси ідеального газу при сталій температурі , об’єми даної кількості ідеального газу обернено пропорційні зовнішньому тиску під яким вони знаходяться. V1 /V2 = P2 /P 1 ; P 1 /P2 = V2/V1
Графічна залежність ізотермічного процесу назив. ізотермою і має вигляд гіперболи.
![]()
Т1 < Т2 < Т3
Для даної маси І. Г. при сталій температурі величина густини та концентрації газу будуть прямо пропорційні їх відповідним тискам. ; P 1 /P2 = ρ1/ρ2 ; ; P 1 /P2 = С1/С2.
Гей – Лисака.
Характеризує ізобарний процес. Р = const V= f (t)
Для даної маси ідеального газу при сталому Р , зміна температури на 1° С призводить до зміни на 1⁄ 273,16 його початкового об’єму виміряного при 0° С.
V t = V0 (1 + 1/273, 16 * t)
Якщо 1/273, 16 = α тоді V t = V0 (1 + α * t)
Графічна залежність називається ізобарою і є лінійною.
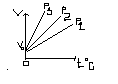
Р1> Р2> Р3
При переході до абсолютних температур з-н набуває іншого формулювання.
Для даної маси ідеального газу при сталому Р , об’єми прямо пропорційні їх абсолютним температурам.
V1 /V2 = Т1/Т2 ;
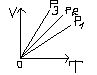
Р1 > Р2 >Р3
