
Правила роботи з світловим мікроскопом
1. Правильно поставити мікроскоп на робочому місці.
2. Ввімкнути мікроскоп
3. Встановити об’єктив малого збільшення навпроти отвору предметного столика на віддалі 1,5 см.
4. На предметному столику мікроскопа встановити гістологічний препарат покривним скельцем доверху так, щоб зріз знаходився навпроти фронтальної лінзи об’єктива.
5. Дивлячись збоку, опустити тубус мікроскопа вниз, залишаючи мінімальний просвіт між об’єктивом і препаратом (до 1 см).
6. Дивлячись в окуляр, повільно піднімати тубус за допомогою макрогвинта вверх до появи зображення досліджуваного об’єкту. Працюючи мікрогвинтом, добитися чіткого зображення препарату.
7. При вивченні препарату за малого збільшення необхідно розглянути його на всій площині.
8. Для вивчення препарату за великого збільшення вибрати найхарактернішу ділянку. Зміна об’єктивів відбувається таким чином: не піднімаючи тубуса, повернути револьвер і встановити об’єктив великого збільшення на оптичній осі мікроскопа.
9. Дивлячись в окуляр, повільно піднімати тубус за допомогою мікрогвинта до появи зображення.
10.Після закінчення роботи з мікроскопом поворотом макрогвинта підняти тубус, зняти з предметного столика препарат, встановити револьвером об’єктив малого збільшення.
11.Вимкнути мікроскоп.

Світловий мікроскоп
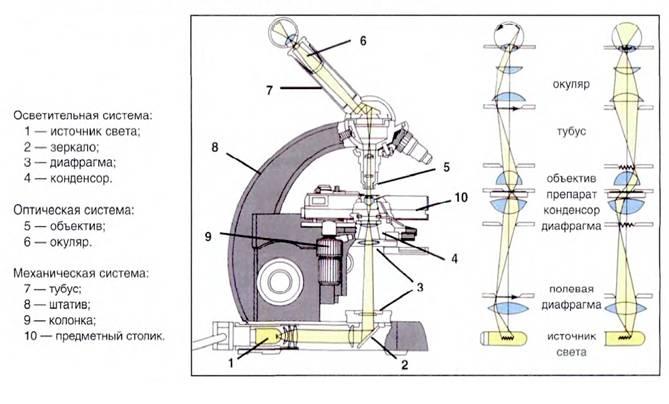
Схема будови світлового мікроскопа
Основні правила вивчення препаратів за допомогою мікроскопа
Розгляд будь-якого препарату починається за малого збільшення, за якого вивчається загальний план його будови. Поглиблене вивчення структурних компонентів проводиться за великого збільшення мікроскопа.
Замалювання мікропрепаратів є одним із етапів вивчення мікроструктур і має за мету закріпити в пам’яті студентів форму і взаєморозміщення окремих його елементів. Замальовування складається із уважного вивчення препарату та графічного відображення деталей його будови. Важливе значення при цьому має відтворення забарвлення гістологічних структур і вибір правильного масштабу малюнку. Замальовування препарату в альбом проводиться різнокольоровими олівцями, на малюнках робляться відповідні позначення.
Методи гістологічного дослідження
Сучасна гістологія має широкий арсенал різноманітних методів дослідження. Усі ці методи поєднує вимога застосування спеціального приладу — мікроскопа, і тому всі вони є мікроскопічними методами. Залежно від стану досліджуваного об'єкта, ці методи поділяють на вітальні (або суправітальні), коли вивчаються живі клітини, тканини, органи і навіть цілі організми, та поствітальні, коли досліджують мертві об'єкти, спеціально вбиті шляхом фіксації.
Методи дослідження живих клітин і тканин
Вивчення живих клітин і тканин дозволяє отримати найбільш повну інформацію про їх життєдіяльності – простежити рух, процеси розподілу, руйнування, росту, диференціювання та взаємодії клітин, тривалість їх життєвого циклу, реактивні зміни у відповідь на дію різних факторів.
Прижиттєві дослідження клітин в організмі (in vivo). Одним з прижиттєвих методів дослідження є спостереження структур в живому організмі. За допомогою спеціальних просвічуюючих мікроскопів-ілюмінаторів, наприклад, можна вивчати в динаміці циркуляцію крові в мікросудинах. Після проведення анестезії у тварини об'єкт дослідження (наприклад, брижа кишечника) виводять назовні і розглядають в мікроскопі, при цьому тканини повинні постійно зволожуватися ізотонічним розчином натрію хлориду. Однак тривалість такого спостереження обмежена. Кращі результати дає метод імплантації прозорих камер в організм тварини. Найбільш зручним органом для імплантації таких камер і подальшого спостереження є вухо тварини (наприклад, кролика). Ділянку вуха з прозорою камерою поміщають на предметний столик мікроскопа і в цих умовах вивчають динаміку зміни клітин і тканин протягом тривалого часу. Таким чином можуть вивчатися процеси виселення лейкоцитів з кровоносних судин, різні стадії утворення сполучної тканини, капілярів, нервів і інші процеси. В якості природної прозорою камери можна використовувати очі експериментальних тварин. Клітини, тканини або зразки органів поміщають в рідину передньої камери ока в кут, утворений рогівкою і райдужкою, і можуть спостерігатися через прозору рогівку. Таким чином була проведена трансплантація заплідненої яйцеклітини і простежено ранні стадії розвитку зародка. Мавпам були пересаджені невеликі шматочки матки і вивчені зміни слизової оболонки матки в різні фази менструального циклу.
Широке застосування знайшов метод трансплантації клітин крові і кісткового мозку від здорових тварин-донорів тваринам-реципієнтам, підданим смертельному опроміненню. Тварини-реципієнти після трансплантації залишалися живими внаслідок приживлення донорських клітин, що утворюють в селезінці колонії кровотворних клітин. Дослідження числа колоній і їх клітинного складу дозволяє виявляти кількість родоначальних кровотворних клітин і різні стадії їх диференціювання. За допомогою методу колонієутворення встановлено джерела розвитку для всіх клітин крові.
Вітальне і суправітальне фарбування. При вітальному (прижиттєве) фарбуванні клітин і тканин барвник вводять в організм тварини, при цьому він вибірково забарвлює певні клітини, їх органели або міжклітинну речовину. Наприклад, за допомогою трипанового синього або літієвого карміну виявляють фагоцити, а за допомогою алізарину – новостворений матрикс кістки.
Суправітальне фарбуванням називають фарбування живих клітин, виділених з організму. Таким способом виявляють молоді форми еритроцитів – ретикулоцити крові (барвник діамантовий крезіловим блакитний), мітохондрії в клітинах (барвник зелений янус), лізосоми (барвник нейтральний червоний).
Дослідження живих клітин і тканин в культурі (in vitro). Цей метод є одним з найпоширеніших. Виділені з організму людини або тварин клітини, маленькі зразки тканин або органів поміщають в скляні або пластмасові посудини, що містять спеціальне живильне середовище, – плазму крові, ембріональний екстракт, а також штучні середовища. Розрізняють суспензійні культури (клітини зважені в середовищі), тканинні, органні і моношарові культури (клітини утворюють на склі суцільний шар). Забезпечуються стерильність середовища і температура, відповідна температурі тіла. У цих умовах клітини протягом тривалого часу зберігають основні показники життєдіяльності – здатність до зростання, розмноження, диференціювання, рух. Такі культури можуть існувати багато днів, місяців і навіть роки, якщо оновлювати середовище культивування і пересаджувати життєздатні клітини в інші судини. Деякі види клітин завдяки змінам у їх геномі можуть зберігатися і розмножуватися в культурі, утворюючи безперервні клітинні лінії. В даний час отримані клітинні лінії фібробластів, міоцитів, епітеліоцитів, макрофагів та ін., які існують багато років.
Використання методу культивування дозволило виявити ряд закономірностей диференціювання, злоякісного переродження клітин, клітинних взаємодій, взаємодій клітин з вірусами і мікробами. Показано можливість хрящових клітин формувати в культурі міжклітинну речовину і здатність клітин наднирників продукувати гормони. Культивування ембріональних тканин і органів дало можливість простежити розвиток кістки, шкіри та інших органів. Розроблено методику культивування нервових клітин. Особливу значимість метод культури тканин має для проведення експериментальних спостережень на клітинах і тканинах людини. Взяті з організму людини клітини при пункції або біопсії можуть у культурі тканин використовуватися для визначення статі, спадкових захворювань, злоякісного переродження, виявлення дії ряду токсичних речовин.
В останні роки клітинні культури широко застосовуються для гібридизації клітин.
Розроблено методи розділення тканин на клітини, виділення окремих типів клітин та їх культивування. Спочатку тканину перетворюють на суспензію клітин шляхом руйнування міжклітинних контактів і міжклітинного матриксу за допомогою протеолітичних ферментів (трипсин, коллагеназа) і з'єднань, що зв'язують Са2+(за допомогою ЕДТА - етилендиамінтетраоцтової кислоти). Далі отриману суспензію поділяють на фракції клітин різних типів за допомогою центрифугування, що дозволяє відокремити важчі клітини від легких, великі від малих, або шляхом прилипання клітин до скла або пластмаси, здатність до якого у різних типів клітин неоднакова. Для забезпечення специфічного прилипання клітин до поверхні скла використовують антитіла, що специфічно зв'язуються з клітинами одного типу. Прилиплі клітини потім відділяють, руйнуючи матрикс ферментами, при цьому отримують суспензію однорідних клітин. Більш тонким методом поділу клітин є мічення антитілами, пов'язаними з флюоресцентними барвниками. Мічені клітини відокремлюються від немічених за допомогою спеціального приладу. Виділені клітини можна вивчати в умовах культивування.
Метод культивування клітин дозволяє вивчати їх життєдіяльність, розмноження, диференціювання, взаємодія з іншими клітинами, вплив гормонів, факторів росту та ін. Культури зазвичай готують з суспензії клітин, отриманої вищеописаним методом дисоціації тканини. Більшість клітин нездатні рости в суспензії, їм необхідна тверда поверхня, у якості якої використовують поверхню пластикової культуральної чашки, іноді з компонентами позаклітинного матриксу, наприклад колагену. Первинними культурами називають культури, приготовані безпосередньо після першого етапу фракціонування клітин, вторинними - культури клітин, пересаджені з первинних культур в нове середовище. Можна послідовно перевивати клітини протягом тижнів і місяців, при цьому клітини зберігають характерні для них ознаки диференціювання (наприклад, клітини епітелію утворюють шари). Вихідним матеріалом для клітинних культур зазвичай служать ембріональні тканини і тканини новонароджених.
В якості поживних середовищ використовують суміші солей, амінокислот, вітамінів, кінської сироватки, екстракт курячих ембріонів, ембріональну сироватку та ін В даний час розроблені спеціальні середовища для культивування різних типів клітин. Вони містять один або кілька білкових факторів росту, необхідних клітинам для життєдіяльності і розмноження. Наприклад, для росту нервових клітин необхідний фактор росту нервів. У більшості клітин у культурі спостерігається певне число поділів, а потім вони гинуть. Іноді в культурі з'являються мутантні клітини, які розмножуються нескінченно і утворюють клітинну лінію (фібробласти, епітеліоцити, міобласти та ін.) Мутантні клітини відрізняються від ракових клітин, також здатних до безперервного поділу, але які можуть рости без прикріплення до твердої поверхні. Ракові клітини в культуральних чашках утворюють більш щільну популяцію, ніж популяції звичайних клітин. Аналогічну властивість можна викликати експериментально у нормальних клітин шляхом трансформації їх вірусами або хімічними сполуками, при цьому утворюються неопластичні трансформовані клітинні лінії. Клітинні лінії нетрансформованих і трансформованих клітин можна довгостроково зберігати при низьких температурах (-70 °С). Генетичну однорідність клітин посилюють клонуванням, коли з однієї клітини при її послідовному розподілі отримують велику колонію однорідних клітин. Клон – це популяція клітин, що походять з однієї клітини-попередниці.
Клітинні гібриди. При злитті двох клітин різних типів утворюються гетерокаріони – клітина з двома ядрами. Для отримання гетерокаріонов суспензію клітин обробляють поліетиленгліколем або інактивованими вірусами для пошкодження плазмолем клітин, після чого клітини здатні до злиття. Наприклад, неактивне ядро еритроцита курки стає активним (синтез РНК, реплікація ДНК) при злитті клітин і перенесення в цитоплазму іншої клітини, що росте в культурі тканини. Гетерокаріон здатний до мітозу, внаслідок чого утворюється гібридна клітина. Оболонки ядер у гетерокаріонів руйнуються, і їх хромосоми об'єднуються в одному великому ядрі. Клонування гібридних клітин призводить до утворення гібридних клітинних ліній, які використовуються для вивчення геному. Наприклад, в гібридній клітинній лінії «миша – людина» встановлено роль хромосоми 11 людини в синтезі інсуліну.
Гібридоми. Клітинні лінії гібридом використовують для отримання моноклональних антитіл. Антитіла виробляються плазмоцитами, які утворюються з В-лімфоцитів при імунізації. Певний вид антитіл отримують при імунізації мишей конкретними антигенами. Якщо клонувати такі імунізовані лімфоцити, то можна отримати велику кількість однорідних антитіл. Однак час життя В-лімфоцитів в культурі обмежений. Тому проводять їх злиття з «безсмертними» пухлинними клітинами (В-лімфоми). В результаті утворюються гібридоми (гібрид-клітина, з геномом від двох різних клітин; ома - закінчення в назвах пухлин). Такі гібридоми здатні розмножуватися тривало в культурі і синтезувати антитіла певного виду. Кожен клон гібридоми є джерелом моноклональних антитіл. Всі молекули антитіл даного виду володіють однаковою специфічністю зв'язування антигенів. Можна отримувати моноклональні антитіла проти будь-якого білка, що міститься в клітині, і використовувати їх для встановлення локалізації білків у клітині, а також для виділення білка з суміші (очищення білків), що дозволяє досліджувати структуру і функцію білків. Моноклональні антитіла застосовують також у технології клонування генів. Антитіла можна використовувати для вивчення функції різних молекул, вводячи їх через плазмолему безпосередньо в цитоплазму клітин тонкою скляною піпеткою. Наприклад, введення антитіл до міозину в цитоплазму заплідненої яйцеклітини морського їжака зупиняє поділ цитоплазми.
Для вітального або суправітального, а також поствітального досліджень нефарбованих гістологічних об'єктів використовують ряд спеціальних методів світлової мікроскопії — фазоконтрастну, темнопольову, флюоресцентну.
Метод фазового контрасту забезпечує необхідну контрастність досліджуваних нефарбованих структур за рахунок спеціальної кільцевої діафрагми, що вміщується в конденсор і так званої фазової пластинки, що міститься в об'єктиві. Така конструкція оптики світлового мікроскопа дає змогу перетворювати фазові зміни світла, що проходить через нефарбований об'єкт, в амплітудні, що помічаються оком як зміни яскравості. У результаті можна розрізнити структури, що мають різні показники заломлення.
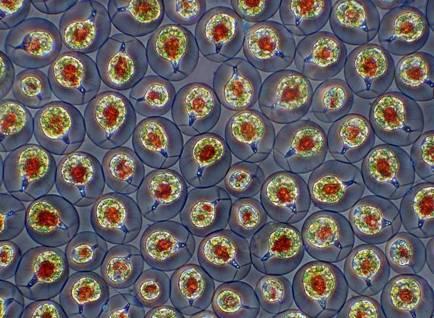
Прісноводні водорості. Фазово-контрастна мікроскопія.
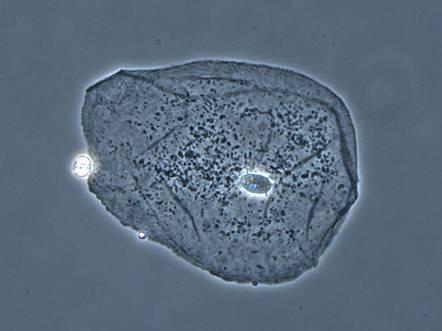
Клітина. Фазово-контрастна мікроскопія.
Метод темнопольової мікроскопії дає змогу бачити нефарбовані структури за рахунок використання спеціального темнопольового конденсора. У результаті на темному тлі видно сріблясті контури об'єктів.

Мізида. Темнопольова мікроскопія.

Водорості. Темнопольова мікроскопія
Люмінесцентна (або флюоресцентна) мікроскопія базується на явищі люмінесценції, тобто властивості живих структур світитися при поглинанні променів короткохвилевої (ультрафіолетової, фіолетової або синьої) частини спектру. При цьому довжина хвилі флюоресценції завжди більша від довжини хвилі збуджуючого світла. Усім живим клітинам властива флюоресценція, яка має назву власної, або первинної. Вона є слабкою, і тому частіше використовують так звану вторинну флюоресценцію, коли об'єкти попередньо обробляють спеціальними барвниками — флюорохромами. З останніх найчастіше вживають акридин оранжевий. При його використанні ядра клітин, що містять ДНК дають яскраво-зелене світіння, а цитоплазма внаслідок наявності РНК — яскраво-червоне.
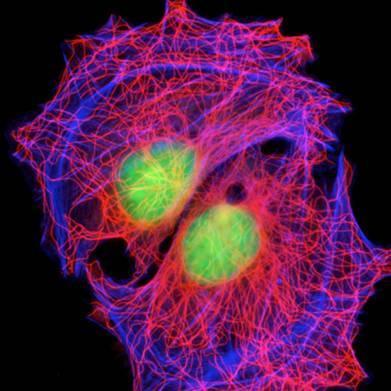
Клітини. Флюоресцентна мікроскопія.
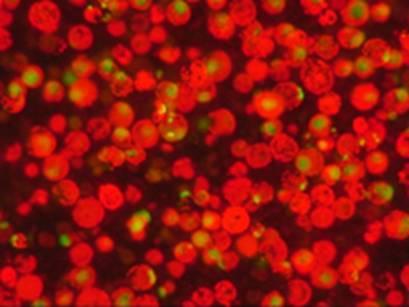
Клітини. Флюоресцентна мікроскопія.
За останні десятиліття значного поширення набули методи гістохімії, авторадіографії, імуноморфології, цитоспектрофотометрії.
Гістохімічний метод дає можливість визначити локалізацію тих чи інших хімічних речовин у різних структурних компонентах клітин і тканин. При гістохімічних дослідженнях речовини, що входять до складу клітин, реагують з хімічними реактивами і утворюють забарвлені продукти реакції, за якими можна визначити як локалізацію, так і до деякої міри, кількісний вміст речовин у тих чи інших структурах. Для прикладу ШИК-реакція дозволяє виявити в тканинах глікопротеїни, полісахариди, деякі муко полісахариди, гліколіпіди та ряд жирних кислот.
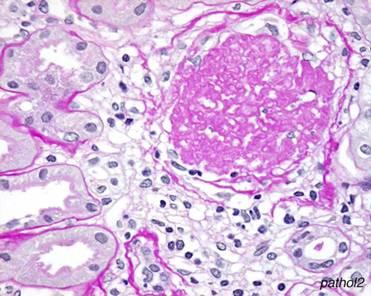
Нирка. ШИК-реакція.
В основі авторадіографічного методу лежить використання радіоактивних ізотопів і мічених ними сполук. Такі сполуки вводять в організм піддослідної тварини, а потім радіоактивні речовини виявляють у гістологічних зрізах за допомогою фотоемульсії, якою вкривають препарат і проявляють. У тих місцях, де фотоемульсія контактує з радіоактивною речовиною, лишаються засвічені ділянки — треки. Цим методом можна досліджувати обмін йоду в щитовидній залозі, утворення нуклеїнових кислот, білків тощо.
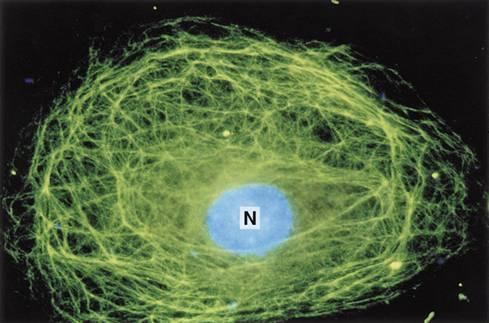
Фото, зроблене з використанням авторадіографічного методу.

Гіпокамп. Авторадіографічний метод.
Імуногістохімічні методи базуються на реакціях антиген-антитіло. Кожна клітина організму має специфічний антигенний склад, який визначається, здебільшого білками. Шляхом імунізації можна отримати відповідні антигенам специфічні антитіла. Антитіла зв'язують з флюорохромами або ферментами. Після обробки досліджуваних гістологічних препаратів у місцях локалізації відповідних антигенів концентруються молекули мічених антитіл, які виявляють або завдяки світінню (люмінесцентна мікроскопія), або на основі відкладання забарвлених продуктів гістохімічної реакції (світлова мікроскопія). Цим методом теоретично можна ідентифікувати будь-які клітини або речовини, продуковані тими чи іншими клітинами, наприклад, гормони, на які здійснюється вироблення антитіл.
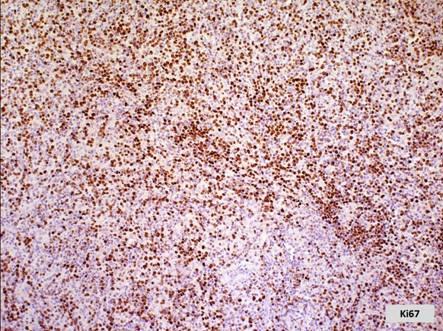
Лімфовузол. Імуногістохімічна реакція із застосуванням Кі-67 – маркеру для визначення проліферативної активності клітин.
Цитоспектрофотометрія — метод кількісного вимірювання вмісту різних речовин у клітині на основі вивчення спектрів поглинання ними світлових променів. Метод проточної цитометрії дає змогу аналізувати характеристики клітин у суспензії, які перетинають сфокусований лазерний промінь. Відповідний прилад має назву цитофлюорографа. За допомогою цього методу можна визначати розміри і форму клітин, їх життєздатність, розділяти клітини вихідної сузпензії на субпопуляції.

Схема розділення клітин вихідної суспензії на субпопуляції
Великим кроком вперед у розвитку техніки мікроскопічних досліджень було створення і застосування електронного мікроскопа, винахідником якого був Емст Руска. В електронному мікроскопі використовується потік електронів з більш короткими, ніж в світловому мікроскопі, довжинами хвиль. При напрузі 50 000 В довжина хвилі електромагнітних коливань, що виникають при русі потоку електронів у вакуумі, дорівнює 0,0056 нм. Теоретично розраховано, що роздільна відстань в цих умовах може бути близько 0,002 нм, або 0,000002 мкм, тобто в 100 000 разів менше, ніж у світловому мікроскопі. Практично в сучасних електронних мікроскопах роздільна відстань складає близько 0,1-0,7 нм.
В даний час широко використовуються трансмісійні (просвічуюючі) електронні мікроскопи і скануючі (растрові) електронні мікроскопи. У трансмісійному електронному мікроскопі потік електронів проходить через об’єкт дослідження і зображення останнього на екрані, відповідно і на фото, є площинне. Для отримання просторового уявлення про структури застосовують скануючи електронні мікроскопи, здатні створювати тривимірне зображення. Растровий електронний мікроскоп працює за принципом сканування електронним мікрозондом досліджуваного об'єкта, тобто послідовно «общупує» гостро сфокусованим електронним пучком окремі точки поверхні. Для дослідження вибраної ділянки мікрозонд рухається по його поверхні. Таке дослідження об'єкта називається скануванням (зчитуванням), а малюнок, по якому рухається мікрозонд, – растром. Отримане зображення виводиться на екран монітоа. Головною перевагою растрової електронної мікроскопії є велика глибина різкості, широкий діапазон безперервної зміни збільшення (від десятків до десятків тисяч разів) і висока роздільна здатність.
Роздільна відстань, або роздільна здатність мікроскопа — це мінімальна відстань між двома точками на гістологічному препараті, які за допомогою мікроскопа можна розрізнити як дві окремі точки, що не зливаються. Роздільна відстань свідчить про найменші розміри структур, які можна розглянути за допомогою даного мікроскопа. На основі роздільної відстані світлового мікроскопа роблять умовний поділ структур на мікроскопічні, тобто більші за 0,2 мкм, ісубмікроскопічні — менші за 0,2 мкм. Останні можна побачити лише під електронним мікроскопом.

Порівняльна схема оптичних шляхів у світловому, трансмісійному та скануючому мікроскопах.

Трансмісійний електронний мікроскоп

Скануючий (растровий) електронний мікроскоп
|
А |
Б |
|
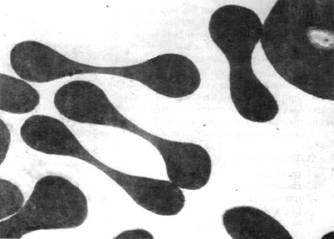
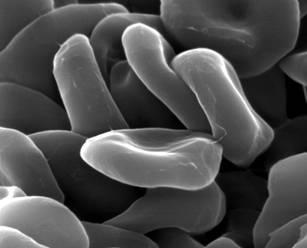
Еритроцити. А – трансмісійна електронна мікроскопія, Б – скануюча електронна мікроскопія | |
|
А |
|
|
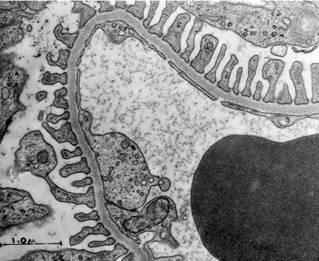
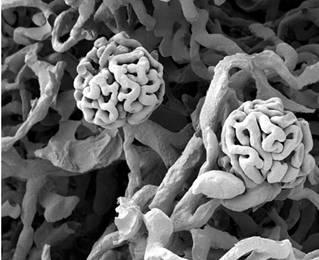
Нирка. А – трансмісійна електронна мікроскопія, Б – скануюча електронна мікроскопія | |
Електронна мікроскопія за методом «заморожування-сколювання» застосовується для вивчення деталей будови мембран і міжклітинних контактів. Для виготовлення сколів клітини заморожують при низькій температурі (–160 °С). При дослідженні мембрани площина відколу проходить через середину бішару ліпідів. Далі на внутрішні поверхні отриманих половинок мембран напилюють метали (платина, паладій, уран), вивчають їх за допомогою трансмісійного електронного мікроскопа та мікрофотографії.
Метод кріоелектронної мікроскопії. Швидко заморожений тонкий шар (близько 100 нм) зразка тканини поміщають на мікроскопічну решітку і досліджують у вакуумі мікроскопа при -160 °С.
Метод електронної мікроскопії «заморожування-травлення» застосовують для вивчення зовнішньої поверхні мембран клітин. Після швидкого заморожування клітин при дуже низькій температурі блок розколюють лезом ножа. Утворені кристали льоду видаляють шляхом сублімації води у вакуумі. Потім ділянки клітин відтіняють, напилюючи тонку плівку важкого металу (наприклад, платини). Метод дозволяє виявляти тривимірну організацію структур. Таким чином, методи заморожування-сколювання і заморожування-травлення дозволяють вивчати нефіксовані клітини без утворення в них артефактів, викликаних фіксацією.
Методи контрастування солями важких металів дозволяють досліджувати в електронному мікроскопі окремі макромолекули – ДНК, великих білків (наприклад, міозин). При негативному контрастуванні вивчають агрегати макромолекул (рибосоми, віруси) або білкові філаменти (актинові нитки).
Електронна мікроскопія ультратонких зрізів, отриманих методом кріоультрамікротомії. При цьому методі шматочки тканин без фіксації і заливки в тверді середовища швидко охолоджують в рідкому азоті при температурі -196 °С. Це забезпечує гальмування метаболічних процесів клітин і перехід води з рідкої фази в тверду. Далі блоки ріжуть на ультрамікротомі при низькій температурі. Такий метод приготування зрізів зазвичай використовують для визначення активності ферментів, а також для проведення імунохімічних реакцій. Для виявлення антигенів застосовують антитіла, пов'язані з частками колоїдного золота, локалізацію якого легко виявити на препаратах.
Рентгеноструктурний аналіз. Для вивчення структури макромолекул на атомарному рівні застосовують методи з використанням рентгенівських променів, що мають довжину хвилі близько 0,1 нм (діаметр атома водню). Молекули, що утворюють кристалічну решітку, вивчають за допомогою дифракційних картин, які реєструють на фотопластинці у вигляді безлічі плям різної інтенсивності. Інтенсивність плям залежить від здатності різних об'єктів в решітці розсіювати випромінювання. Положення плям в дифракційній картині залежить від положення об'єкта в системі, а їх інтенсивність свідчить про його внутрішню атомну структуру.
Становлення поствітального методу, або методу виготовлення постійного гістологічного препарату, відбувалося паралельно із становленням самої науки гістології у другій половині XIX ст. Його називають ще методом класичної гістології. Цей метод, що має назву гістологічної, або мікроскопічної техніки, вимагає досить складної підготовки об'єкта дослідження. Остання є предметом для написання спеціальних, досить великих за обсягом посібників. Студентові, який починає вивчати гістологію, необхідно ознайомитись з основами техніки виготовлення гістологічних препаратів для того, щоб краще зрозуміти ці препарати і навчитися їх аналізувати, «читати», бо саме постійні гістологічні препарати широко використовуються як в навчальному процесі, так і в наукових дослідженнях.

 Б
Б